Cell: 代谢物分析驱动代谢疾病的发现、诊断和治疗
2022年7月,得克萨斯大学西南医学中心、纽约纪念斯隆·凯特林癌症中心的相关研究人员在《Cell》(IF: 66.9)上发表了题为“Metabolic analysis as a driver for discovery, diagnosis, and therapy”的综述文章,回顾了代谢分析的最新进展,讨论了代谢组学如何提供信息丰富的表型维度,并概述代谢分析当下面临的挑战。

人类和其他生物体的许多表型涉及代谢的重新编程。疾病相关的代谢紊乱可以是固定的(例如,由种系突变定义)或可逆的(例如,营养缺乏、暂时性组织缺氧),可能涉及局限于特定细胞类型的简单缺陷或系统内稳态的复杂改变。在发达国家,心脏病、中风、糖尿病、癌症等大多数常见死亡原因的特点是代谢变化导致组织功能障碍。代谢在基本细胞过程中的重要性以及用于代谢网络的大部分基因组解释了代谢改变在疾病中的突出地位。这些联系使得识别与表型变异相关的代谢特征很有吸引力。最近的进展使得能够详细描述疾病相关的代谢改变。这涉及将新兴技术应用于代谢研究,并重新利用已建立的技术,如稳定同位素追踪,以探测体内与疾病相关的代谢扰动。这些努力产生了新的治疗目标,并对代谢性疾病的机制基础有了新的认识。
这篇综述旨在提供代谢方法学最新进展的调查,强调与人类疾病特别相关的四个方面,以及在未来十年实现许多新发现的潜力。
组织代谢组学提供了有关疾病代谢紊乱的丰富知识。然而,单细胞RNA研究表明,了解复杂微环境中单个细胞的代谢对于理解发病机制至关重要。有四个原因。首先,同一组织内不同类型的细胞具有特殊的代谢特性。大脑中神经元和星形胶质细胞之间的代谢分区就是这一概念的一个例子。其次,细胞在微环境中的位置影响其代谢。示例包括肝小叶内的分区代谢通量,以及接近血液供应对肿瘤内癌细胞代谢的影响。第三,一些稀缺细胞,例如干细胞和祖细胞,被认为在代谢上与组织的其他部分不同,但几乎不可能从大量分析中推断出它们的代谢活性。第四,即使在单个细胞内,代谢也在细胞器和其他结构内进行划分,以实现精确调节。最近的进展解决了小规模评估代谢的挑战。
单细胞和稀有细胞群代谢组学
鉴于传统的代谢组学方法需要105-106个细胞,小规模代谢组学是由对稀有细胞群体进行特征化的需要驱动的。代谢组学可以与敏感的代谢通量测量相结合,包括用超极化核磁共振 (NMR) 进行同位素示踪。这提供了对代谢物周转定量速率的深入了解。最近的工作表明,这可以在少至 9,000个细胞中提供通量测量,并在与微线圈系统耦合时应用于流式分选癌症干细胞的研究。
除了直接代谢物测量之外,其他分析方法可以提供有关代谢网络的信息,有时是单细胞分辨率。单细胞 RNA 测序可以确定复杂组织内代谢相关基因的水平。细胞计数/飞行时间 (TOF) 质谱 (CyTOF) 等蛋白质组学方法为免疫细胞群内的代谢异质性提供了更丰富的认识。其他工作利用光学方法使用 FRET 传感器来量化代谢物,如氨基酸和氧化还原辅因子。与活细胞成像一起,这提供了有关代谢特征如何与细胞生物学相关的实时信息。这些方法需要细胞工程,并且通常与高通量筛选不兼容。内源性代谢物的传统光学成像(例如双光子显微镜)提供了一种“无探针”策略,可用于检测氧化还原辅助因子。尽管这些方法需要进一步开发,但将它们与快速发展的空间质谱成像 (MSI) 方法相结合可能有助于评估小规模应用中的实时通量。
代谢物成像
细胞分离提供了一种富集感兴趣细胞的方法,但消除了在组织内绘制代谢物空间图谱的能力。在过去的10年里,已经开创了多种方法来满足这一需求。利用现代质谱系统灵敏度的提高,许多成像方法已被串联到光栅扫描并生成空间代谢组学数据。基质辅助激光解吸电离(MALDI)已成为最广泛使用的空间质谱方法,通常通过将样品切片至5-10 mm厚并将切片放置在移动台上进行,在移动台上以光栅化方式记录质谱数据,以重建3D数据集(2D空间和1D光谱)。空间分辨率(50–100 mm)仍然限制了真正的单细胞分析。已有为培养中的细胞开发有趣的方法,并将其应用于试图推断单细胞测量的组织切片,这将是进一步发展的关键领域。
组成代谢网络的反应几十年前就已经知道了。然而,关于如何建立环境相关的代谢需求的问题仍然存在。筛选方法在新陈代谢研究中已经变得越来越普遍,这些方法的开放性已经产生了许多非直观的发现。本节讨论两种筛选技术: 功能基因组学使用优化的文库来探测新陈代谢和化学文库筛选来鉴定新陈代谢的脆弱性。
功能基因组学
人类有超过2000个“代谢”基因,这意味着全面分析需要高通量方法。哺乳动物细胞功能基因组学技术使研究人员能够以无偏见的方式识别代谢脆弱性,而无需预先假设存在哪些重要途径。
基于CRISPR的筛选已用于识别许多代谢问题,有时解决了细胞生物学中长期存在的难题。例如,依赖于功能基因组学提供的对代谢依赖性的无偏、全局评估发现,电子传递链(ETC)在增殖细胞中的主要功能是产生天冬氨酸而不是能量,肿瘤缺氧区域的天冬氨酸水平不足以支持细胞生长。类似的筛选也确定了产生致命毒素诱导的氧化应激的酶和氧化还原稳态的新机制。
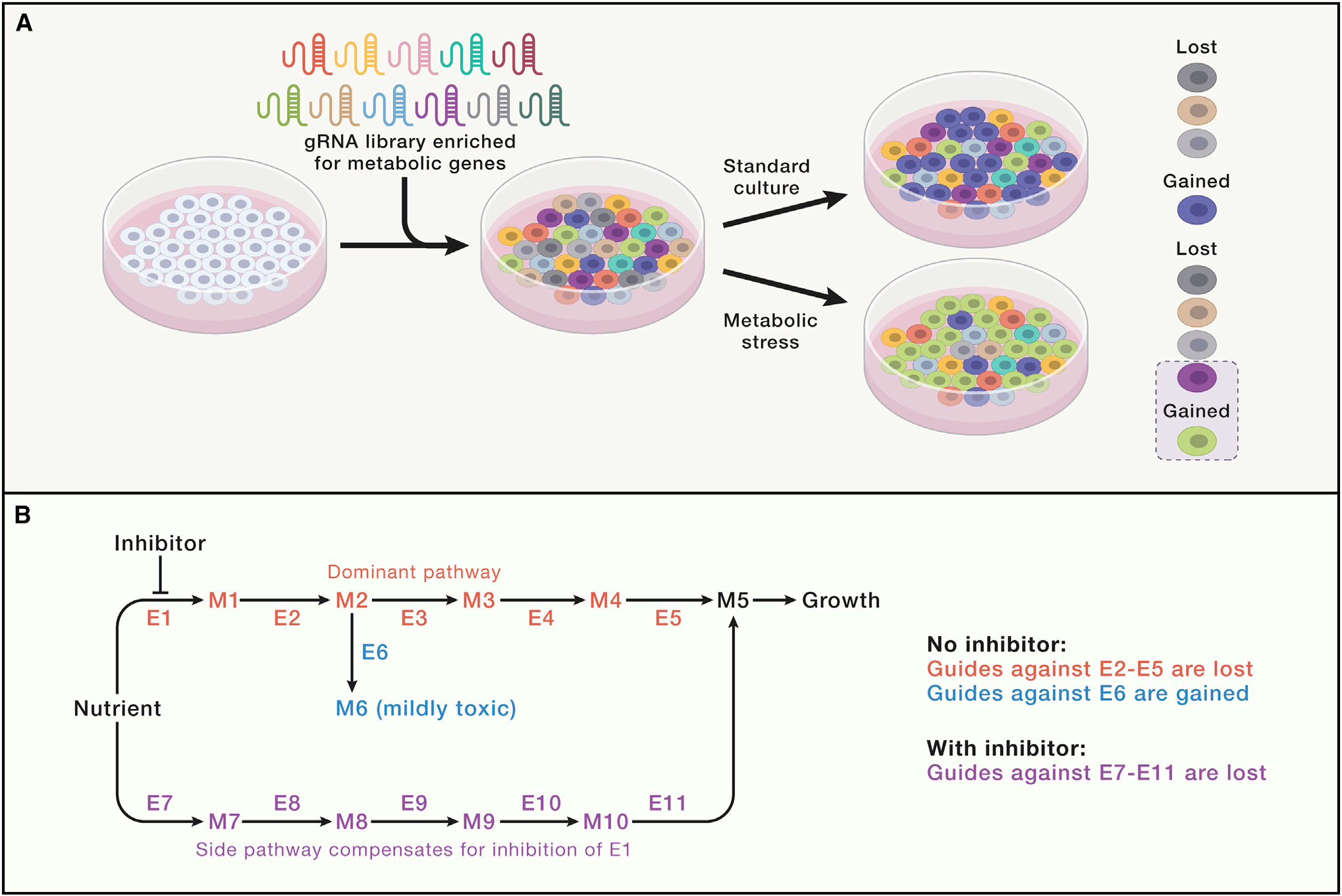
高通量筛选以确定细胞对代谢应激的反应机制
用小分子调节新陈代谢
数百种针对代谢酶和营养转运蛋白的抑制剂作为工具化合物存在,或者在某些情况下,作为临床领域的药物存在。富含这些抑制剂的化学文库已被用于识别综合致命的相互作用,揭示了新陈代谢在细胞对其他过程的阻断反应中的意外作用。例如,这种化学筛选方法表明,谷胱甘肽消耗与去泛素酶抑制在乳腺癌中具有协同作用,这可能反映了去泛素化在减轻氧化应激过程中错误折叠蛋白质积累的重要性。
代谢物结合酶上的变构位点,这是调节通路活性的常见机制。尽管许多此类相互作用是已知的,但寻找代谢物-蛋白质相互作用的公正方法可以揭示新的调节模式。最近的一种方法使用平衡透析和质谱法来检测文库中可以与纯化蛋白质结合的代谢物。筛选 33 种蛋白质后发现了数百种相互作用和几个新的调控位点。在一种这样的相互作用中,发现长链酰基辅酶 A 与乳酸脱氢酶 A (LDHA) 结合并在低微摩尔浓度下抑制其活性,暗示了乳酸和脂肪酸代谢之间的一种新调节模式,在 LDHA 水平上发挥作用。上述发现都表明,无偏筛选丰富了我们对代谢的理解。
远交种群包含大量的代谢异质性,其中大部分是由遗传决定的,有些与疾病有关。识别导致代谢异质性并与疾病相关的基因组变体一直是一个长期的挑战。最近,基因组学和代谢组学的分析进展使得对代谢变异的遗传基础进行整体和综合评估成为可能。本节介绍了这一领域的概念和实践进展。
小鼠和人类代谢的遗传调节因子
为了利用小鼠作为模型系统来了解代谢的遗传决定因素,已有研究将代表常用实验室小鼠中大多数遗传多样性的八个近交系进行杂交,以创建多样性远交(DO)种群。个体DO小鼠之间存在数百万个单核苷酸多态性差异,这使得利用遗传学来识别与代谢特征相关的变体成为可能。
类似的方法也被用于人类,利用不同人群的自然变异,并将全基因组关联研究与代谢组学相结合。这些研究表明,编码代谢酶的基因多态性占健康人血浆中代谢物丰度自然变化的很大一部分。除了代谢物丰度外,许多效应在表型上是沉默的,但一些基因型代谢物关联涉及以前与常见多因素疾病(如冠状动脉疾病、高血压和糖尿病)相关的基因。
人类罕见疾病的代谢组学
代谢组学越来越多地用于表征罕见的人类表型,尤其是当全外显子组测序和全基因组测序(WES,WGS)已在临床上用于诊断孟德尔疾病时。WES和WGS在检测潜在致病性基因组变异方面的能力无与伦比。然而,序列优先方法的一个挑战是解释意义不确定的变体,即不同于共识但对基因功能影响未知的序列变体。在这种情况下,代谢组学提供了深层表型的有用维度。临床生化实验室对先天性错误的常规检查侧重于几十种代谢物,但现代代谢组学可以一次报告数百种代谢物。这使得有可能观察到具有非特异性表型的患者中罕见的代谢异常模式,并将其与WES/WGS发现的罕见基因组变体联系起来。
总的来说,将基因组学与代谢谱相结合为可遗传代谢异质性的基础提供见解,在某些情况下,还为常见代谢疾病(如血脂异常)提供新的治疗方法。在罕见的单基因疾病的情况下,广泛的代谢组学分析提高了临床基因组学的效用,提供了一个深刻的表型维度,澄清了基因组变异的重要性。

整合代谢组学和基因组学以识别代谢异常的分子基础
虽然代谢机制可以在实验模型中很容易地梳理出来,但大多数分析方法都具有破坏性或需要长时间的数据采集,限制了其在患者中的可行性。体内代谢成像的新方法提供了一种利用这种代谢变化更好地理解人类生物学的方法。这些方法包括核医学(本文主要是正电子发射断层扫描术(PET))和磁共振的方法,这些方法能够解析人体内的代谢通量。
代谢成像的放射性方法
从历史上看,PET一直是探索人类新陈代谢的标准。从最广泛使用的示踪剂18F-氟脱氧葡萄糖(FDG)开始,PET扫描就被用来推断糖代谢的变化,尤其是在肿瘤学和心脏病学中。虽然PET扫描的放射性剂量相当低,但它限制了特定患者,尤其是儿童的PET扫描数量。最近的研究开发了全身PET扫描仪(EXPLORER),可提高灵敏度,并将放射性剂量降低10倍。信号强度增益可用于获取与时间相关的数据,而不是传统PET中累积离子数的总和。此外,随着全身信号的时变和灵敏度的提高,可以使用TOF PET成像更好地定位信号。由于放射性核素的定位是测量相隔180度撞击PET探测器的重合光子的精度的函数,TOF PET成像利用光子检测时间的高精度测量(皮秒级)来改进定位。将这些进展结合在一起,并用新的重建方法对其进行补充,探索者中的TOF PET有可能在系统级跨广泛组织拟合动力学速率模型,有望实现全身测量。18F类似物虽然具有相当长的寿命,但其代谢受到限制,因为它们与代谢反应的天然底物不具有相同的代谢。因此,人们重新探索了13N和11C类似物在代谢成像研究中的应用。例如,11C醋酸盐不仅有可能告知脂肪酸代谢,而且还有不同程度的乙酰化。
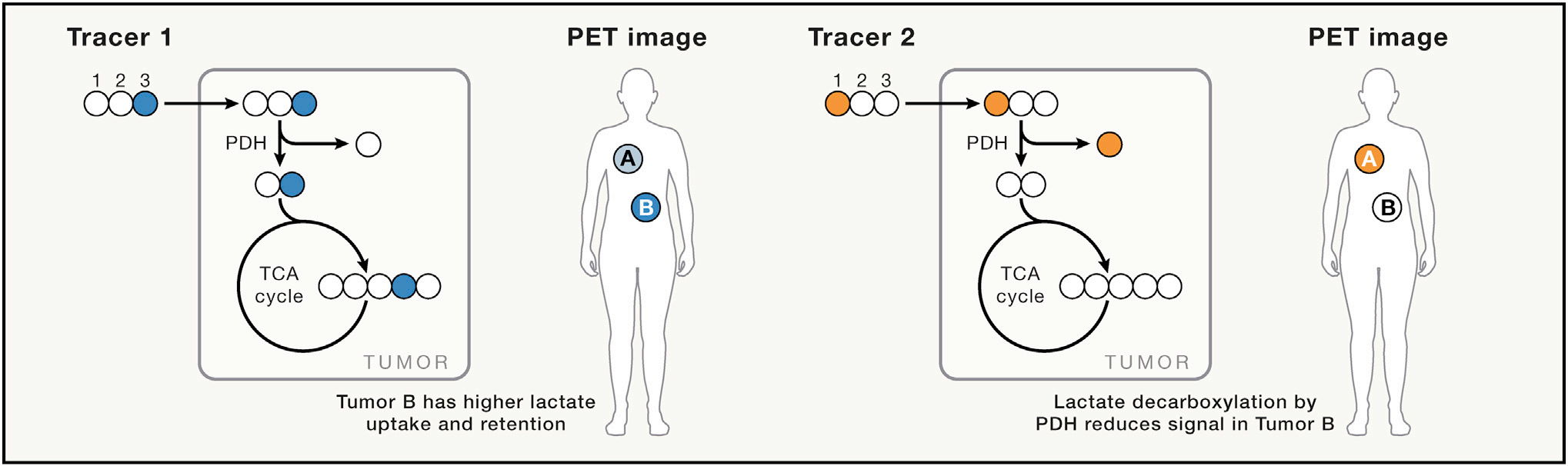
同位素选择性体内 PET 成像作为揭示差异代谢的一种手段
用于代谢成像的稳定同位素方法
PET 方法提供高灵敏度但相对低的特异性和空间定位。相比之下,磁共振成像(MRI)提供了精细的空间分辨率和特异性,但缺乏量化代谢过程通常所需的灵敏度。近年来开创的几种 MRI方法试图解决研究人类新陈代谢日益增长的需求。稳定同位素示踪是一种通用方法,可提供有关体内代谢活动的信息。最近使用稳定同位素标记的营养素的努力揭示了与疾病相关的代谢活动的新方面,包括丝氨酸在小鼠肝脏脂肪生成中的意外作用以及使用乳酸作为侵袭性人类肺部肿瘤的能量底物。
方便的是,用于示踪的相同同位素(2H、13C 和 15N)可以使用 MRI 和磁共振波谱 (MRS) 检测到。尽管这种追踪方法的敏感性仍然有限,但在癌症和其他疾病环境中的工作已经证明,能够注入同位素标记的营养物质并以非侵入性方式跟踪它们的代谢转化。例如,在大脑中,来自 13C-乙酸和 13C-葡萄糖等底物的通量可用于测量谷氨酰胺和谷氨酸盐的回收率。
到目前为止,使用同位素示踪剂对代谢活动进行原位成像领域最令人兴奋的进展是超极化磁共振成像的发展。超极化是指对于给定的磁场,目标核的自旋极化在其玻尔兹曼状态之外的大量增加。使用传统的 MRI 系统检测这些超极化自旋,将信号增强数千倍。尽管现在有多种方法可以产生超极化细胞核,但所有这些方法的最终目标都是产生一种超极化营养物质,该营养物质可以注入生命系统以测量酶转化。
这些快速发展的磁共振方法正接近黄金时期。在过去10年中,这些技术的真正突破为研究疾病的代谢维度提供了新的机会。
在定义了人类代谢网络的基础上,上述技术和概念进步对代谢和疾病之间的界面产生了新的见解。未来的发现也有许多令人振奋的机会。
将代谢途径定位到膜封闭的细胞器(如线粒体)是代谢调节的一个众所周知的组成部分。然而,越来越多的人认识到,一些途径也与“代谢物”相关,即不会与细胞其他部分隔离的大分子复合物。我们不知道完整的功能性哺乳动物代谢物,它们如何被调节以匹配代谢供需,以及哪些与疾病有关。先进的细胞成像方法可以帮助研究生物分子凝聚物和其他有助于代谢的亚细胞定位机制,以评估活组织中的蛋白质定位和大分子结构,以及可以可视化代谢物分布的新细胞内传感器。
MALDI 和相关的 MSI 技术已经允许在组织切片内定位一些代谢特征,但仍然难以将特征分配给复杂组织内的特定细胞类型。代谢 MSI 将受益于进一步的方法开发,以在同一样品中叠加多个空间分辨特征,基本上将转录组学、蛋白质组学、代谢组学,甚至可能是同位素富集特征与高分辨率组织学数据进行复用。
最后,由于识别和量化代谢机制推动了我们对疾病的理解,因此定位患者的代谢紊乱是我们利用这些发现来解决疾病的关键。临床代谢成像的快速发展已经开始,预计新的发展将使我们能够以前所未有的方式阐明通路。鉴于临床成像工具(例如代谢 MRI 和 PET)的互补性,将这些方式相互融合并使用广泛的代谢探针可以提供系统代谢的整体视图,这有可能改变我们处理代谢疾病的研究、诊断和治疗的方式。





