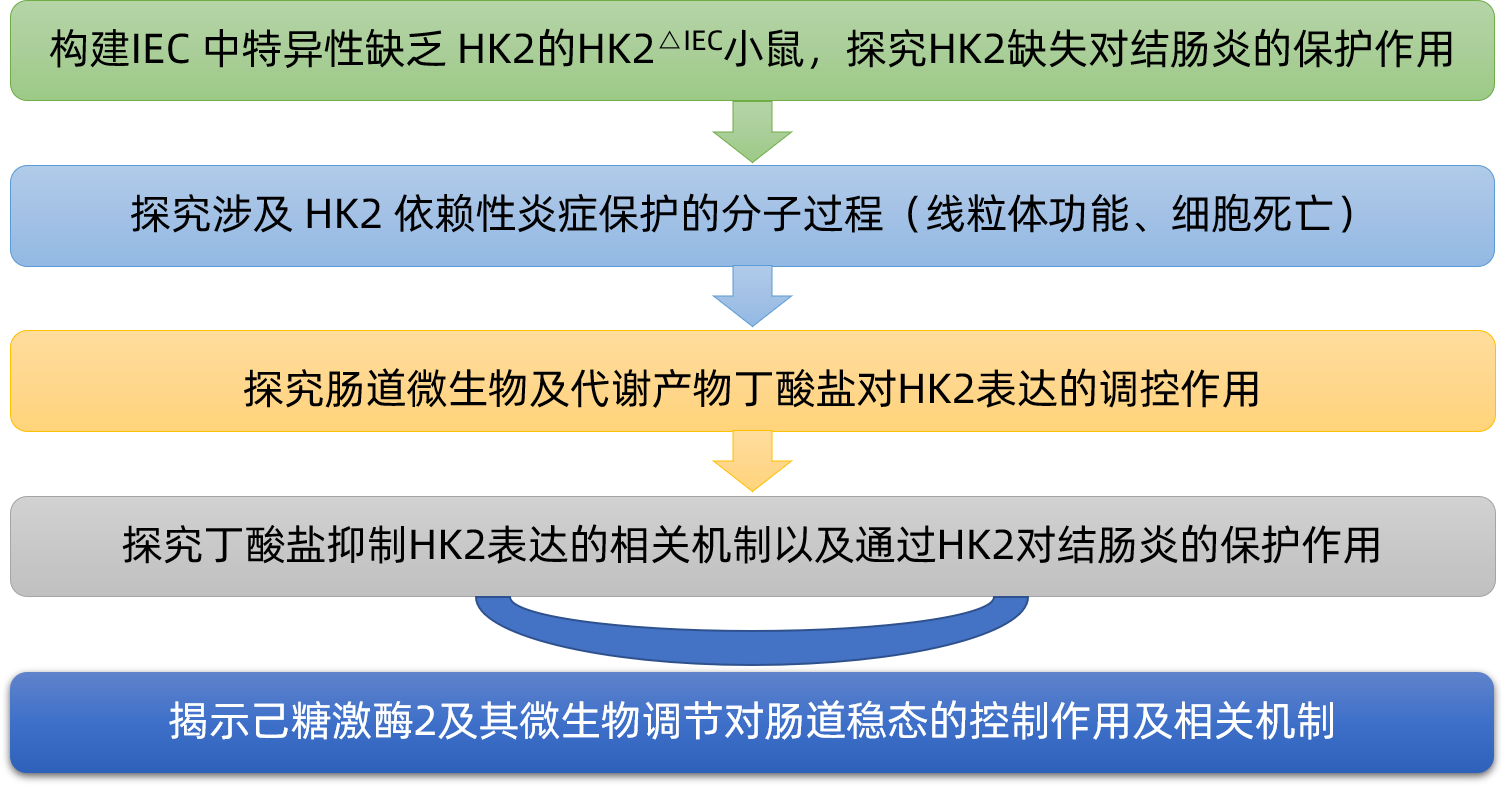
Cell Metabolism:己糖激酶2的微生物调节与结肠炎中的线粒体代谢和细胞死亡有关
2021年11月,德国基尔大学等单位的相关研究人员在《Cell Metabolism》(IF: 27.3)上发表了题为“Microbial regulation of hexokinase 2 links mitochondrial metabolism and cell death in colitis”的研究论文,揭示了己糖激酶2及其微生物调节对肠道稳态的控制作用及相关机制。

亮点概述:
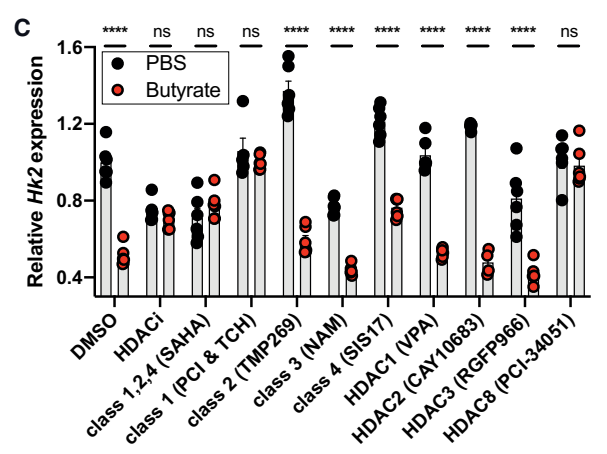
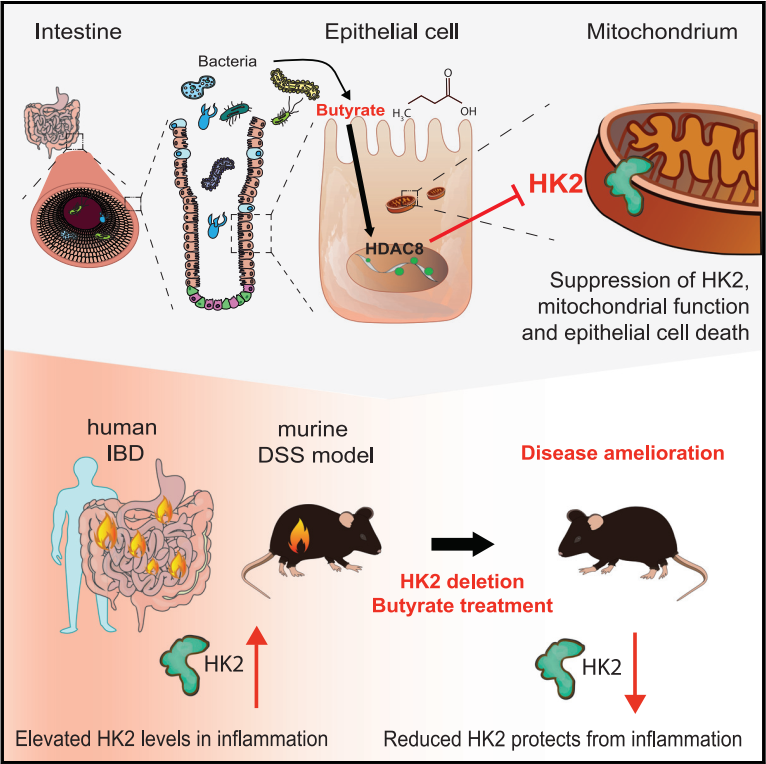
上皮己糖激酶2(HK2)缺失可预防急性肠道炎症 HK2 的消融抑制细胞死亡和线粒体功能失调 微生物组通过靶向组蛋白脱乙酰酶 8( HDAC8) 的短链脂肪酸(SCFA)调节 HK2 表达 丁酸盐通过下调 HK2 来改善肠道炎症 研究背景: 己糖激酶 (HK) 催化糖酵解的第一步,从而限制了这一基本生物过程的速度。HK2可以被各种环境因素和信号通路上调,例如在炎症和炎症性肠病 (IBD) 期间。除了其代谢功能外,HK2 还充当细菌细胞壁成分的受体,并被认为可以对抗线粒体介导的细胞死亡。HK 的化学抑制会损害免疫细胞活化并促进免疫细胞中单核球增多性李斯特菌的感染,而高血糖和高糖酵解通量与肠上皮细胞肠道感染的风险增加有关。在肠道中,HK2 主要由肠上皮细胞 (IECs) 表达。 为了确定上皮 HK2 在肠道炎症中的作用,研究人员生成了在 IEC 中特异性缺乏 HK2的小鼠(HK2△IEC小鼠)。发现当HK2△IEC小鼠及野生型(WT)同窝仔鼠受到葡聚糖硫酸钠 (DSS)处理导致肠道炎症时,与 WT鼠相比,HK2△IEC小鼠的体重减轻明显更少。疾病活动指数 (DAI)是一种衡量肠道炎症的指标,包括体重减轻、粪便稠度和粪便血液发生率,其证实了HK2△IEC小鼠的病程有所改善。此外,通过 ELISA 测量,HK2△IEC小鼠显示出较低的促炎细胞因子KC/CXCL1 血清水平。H&E 染色的结肠切片的组织学评估表明,HK2△IEC小鼠的分数降低,包括透壁炎症、隐窝增生、上皮损伤以及多形核和单核细胞浸润。在 WT 小鼠中,HK2 水平在结肠炎过程中增加。 研究人员接着通过评估来自患者粘膜活检的表达数据来研究 HK2 表达是否在患有肠道炎症的患者中失调,发现在儿童 IBD 中,与健康对照相比,IBD 患者活检中的 HK2 显著上调。儿童克罗恩病 (CD) 、溃疡性结肠炎 (UC) 、IBD 和非 IBD 结肠炎 (NIC)、原发性硬化性胆管炎 (PSC) 的患者均显示 HK2 表达上调,表明 HK2 与 IBD 相关疾病之间可能存在相关性。 为了阐明HK2△IEC小鼠免受肠道炎症的分子机制,研究人员在不同炎症期从WT和HK2△IEC小鼠中分离出IEC,并进行RNA测序。差异表达基因的基因本体论(GO)分析显示,HK2△IEC小鼠中参与细胞死亡信号和线粒体膜通透性调节的基因下调。此外,HK2△IEC小鼠在炎症期间相较于WT小鼠的细胞死亡减少。 肠道上皮中 HK2 的缺失可预防结肠炎 为了进一步探究涉及 HK2 依赖性炎症保护的分子过程,研究人员生成了来自HK2△IEC和 WT 小鼠的肠道类器官,肿瘤坏死因子 (TNF) 刺激后,HK2 水平增高。与WT 类器官相比,源自HK2△IEC小鼠的类器官表现出较低水平的裂解Caspase3 和多聚ADP核糖聚合酶1(PARP1),这是线粒体相关类型细胞死亡的标志物。研究人员还使用 CRISPR Cas9 系统生成了一个缺乏 HK2 的 Caco-2 细胞克隆(Caco-2△HK2)。细胞外酸化率 (ECAR)的测量表明 HK2 的消融不影响糖酵解功能。基础耗氧率 (OCR)测定发现,与 Caco-2WT 细胞相比,Caco-2△HK2 细胞的基础线粒体呼吸以及最大线粒体呼吸都显著降低,表明 Caco-2△HK2 细胞中线粒体电子传递链(ETC)受损。研究人员在筛选参与调节线粒体膜通透性的差异表达基因的转录组数据时,观察到 Ppif(肽基-脯氨酰顺反异构酶)的 mRNA 水平下调,该酶编码 HK2△IEC小鼠在结肠炎第 7 天的 IEC 中线粒体通透性转换孔(MPTP)的主要成分。PPIF 协调线粒体通透性和代谢并已被建议直接与 HK2 相互作用以抑制细胞死亡。在用 TNF 和 IL17A以及 IFN-b 刺激 Caco-2△HK2 和 Caco-2WT 细胞以诱导炎症反应和细胞死亡时,Ppif 表达在两种条件下都被下调,这验证体内发现和转录组数据。从机制上讲,HK2 依赖性肠道炎症保护可能是由较低水平的 PPIF 和随后 MPTP 开放和线粒体膜通透性的降低所介导的。 HK2缺失导致线粒体功能失调 失调的宿主-微生物群相互作用是肠道炎症的关键因素。通过比较从无菌 (GF) 和常规培养 (CR) C57BL6/J 小鼠中分离的肠上皮细胞部分的转录组,研究人员发现微生物群强烈调节HK2的表达和活性。微生物代谢物丁酸盐可能通过 HK2 和 PPIF 介导的线粒体功能和细胞死亡变化来防止炎症。丁酸盐的膳食补充剂在小鼠体内也能起到下调 HK2 水平的作用,并改善了结肠炎结果,但不能保护 Hk2△IEC 小鼠免受结肠炎的侵害。此外,丁酸盐处理可降低Caco-2WT小鼠的线粒体呼吸,但在Caco-2△HK2细胞中不起作用。 研究人员最后探究了丁酸盐抑制HK2表达的相关机制。丁酸盐直接作用于组蛋白脱乙酰酶 (HDAC),其作为表观遗传调节剂发挥作用,从而可能影响 HK2 表达。研究人员在使用泛 HDAC 抑制剂或类特异性抑制剂后,发现阻断所有 HDAC 或仅 I 类 HDAC(HDAC 1、2、3 和 8 一起)消除了丁酸盐对 HK2 表达的抑制。研究人员随后通过使用单一 HDAC 酶特异性抑制剂研究了单个 I 类 HDAC 的作用,发现仅有HDAC8 抑制剂消除了丁酸盐对 HK2 的转录抑制,表明了HDAC8(I 类 HDAC)在介导 HK2 的丁酸盐依赖性调节中的特定作用。 HDAC8 介导丁酸盐对 Hk2 表达的抑制 综上所述,该研究揭示了一个由肠道上皮HK2和微生物代谢物丁酸盐组成的新型调节回路。HK2敲除可通过抑制与线粒体功能改变相关的细胞死亡来预防结肠炎,这可能是由于MPTP的PPIF依赖性开放所致。此外,该研究确定肠道微生物群及其代谢物丁酸盐是HK2的有效调节剂,饮食中补充丁酸盐的保护作用取决于HK2的功能存在。未来可能通过靶向HK2来指导更特异的治疗选择的发展。