Nature Communications:杨洪远团队揭示脂类合成以及脂肪组织发育障碍的新机制
2021年11月,澳大利亚新南威尔士大学等单位的相关研究人员在《Nature Communications》(IF: 14.9)上发表了题为“AGPAT2 interaction with CDP-diacylglycerol synthases promotes the flux of fatty acids through the CDP-diacylglycerol pathway”的研究论文,揭示了甘油-3-磷酸途径的主要分支点处的底物通道,为脂质合成过程中代谢通量的调节提供了重要的见解。

1-酰基甘油-3-磷酸O-酰基转移酶2(AGPAT2) 缺乏导致超大 脂滴(LDs)的形成和初始 LD 脂化的延迟
AGPAT2缺乏会损害CDP二酰甘油(DAG)合成酶(CDSs)的稳定性,并降低细胞系和小鼠肝脏中的CDS活性
AGPAT2和CDS1/2可以直接相互作用并形成功能复合物,促进磷脂酸(PA)沿着磷脂合成的CDP-DAG途径代谢
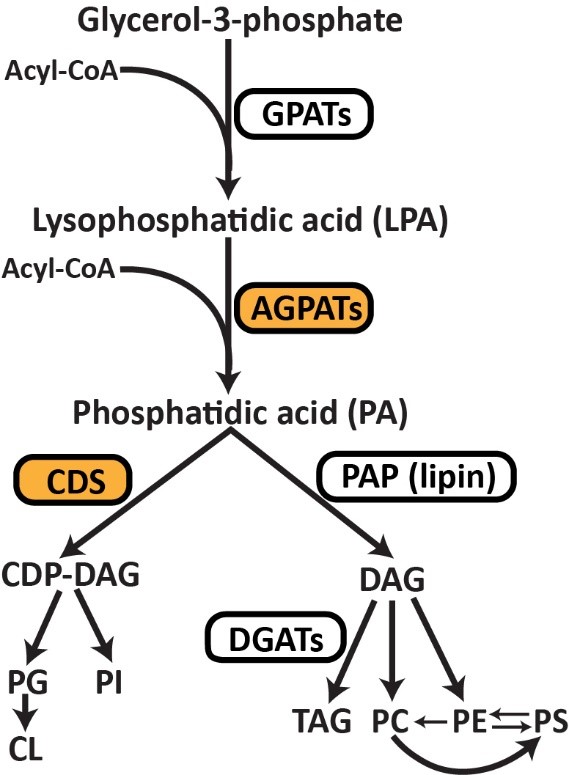
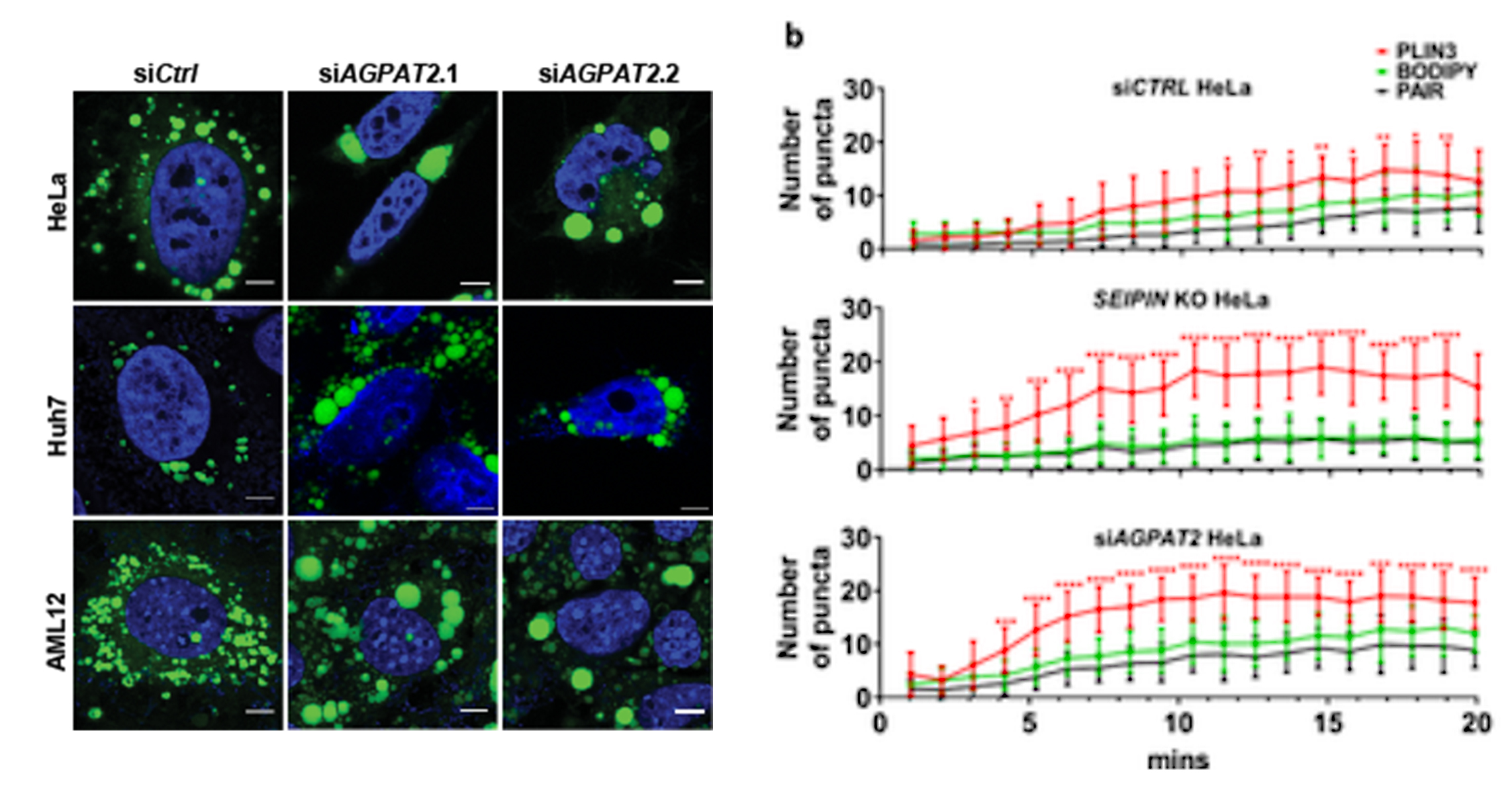
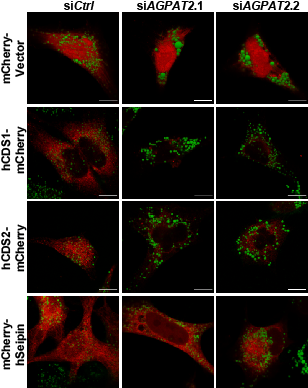
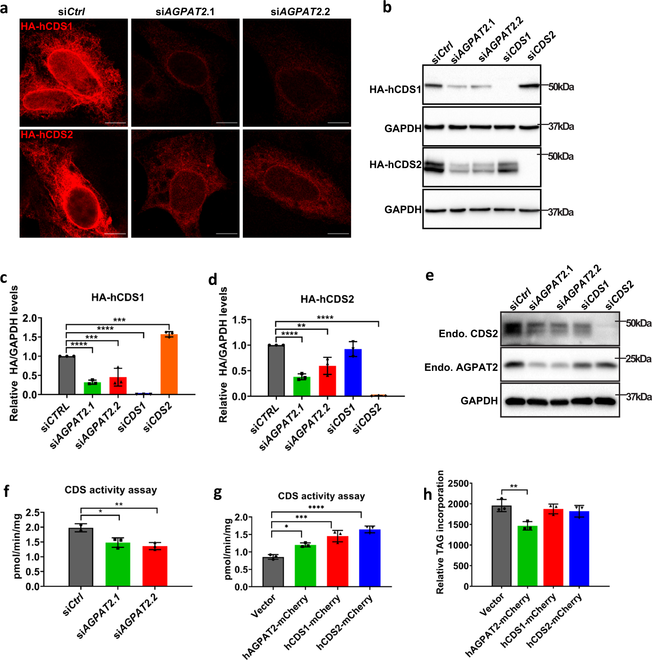
1-酰基甘油-3-磷酸O-酰基转移酶(AGPATs)是通过甘油-3-磷酸途径生物合成磷脂和三酰甘油(TAG)的中间酶(见图)。AGPATs催化溶血磷脂酸(LPA)酰化形成磷脂酸(PA),这是一种关键中间体,可通过PA磷酸酶(PAP,例如,脂肪酶)脱磷酸为二酰甘油(DAG),或通过CDP-DAG合成酶1和2(CDS1和2)转化为CDP-DAG。AGPAT2是唯一一种功能缺失突变导致严重的人类先天性全身性脂肪营养不良的AGPAT亚型。矛盾的是,已知 AGPAT2 缺乏会显着增加其产物 PA 的水平。AGPAT2是否以及如何影响LD的形成尚不清楚。 鉴于其 ER 定位和对 PA 代谢的已知影响,AGPAT2 可能调节 LDs 的形成。为了验证这一假设,研究人员通过siRNA在三种不同的细胞系(HeLa、Huh7 和 AML12)中敲除AGPAT2。在所有三种细胞系中长时间的油酸处理(18 h)后,发现AGPAT2 缺陷导致形成巨大的 LDs(直径 >2 μm 的 LD)。考虑到PA在 AGPAT2 缺陷细胞中显着增加,研究人员接着探讨AGPAT2 缺陷是否也可能影响 LD 形成的早期步骤。为了研究这种可能性,研究人员通过基因组工程用 mCherry 标记了内源性 perilipin 3 (PLIN3)。PLIN3 是一种内源性蛋白质,表明 LD 形成的最早步骤,而诸如 LipidTox/BODIPY 之类的亲脂性染料仅对已获得大量中性脂质的 LD 染色。研究人员还使用 seipin 敲除细胞作为对照,因为已知 seipin 缺乏会损害早期 LD 形成。结果发现,在WT细胞中,当油酸添加诱导LD形成时,PLIN3迅速积累在变大的小斑点中,并在20 分钟内变为BODIPY阳性。在 seipin 和 AGPAT2 缺陷的细胞中,在油酸处理的 10 分钟内,PLIN3 斑点的数量急剧增加,而BODIPY 阳性 LD 比 WT 细胞少得多。 AGPAT2 缺乏导致超大 LDs 的形成和初始 LD 脂化的延迟 研究人员接着探究AGPAT2 缺陷下异常 LD 生物发生和形成的分子基础。用已建立的 siRNA 敲低二酰基甘油酰基转移酶(DGAT)1 或 2 并没有完全恢复 AGPAT2 缺陷细胞中 LD 的正常大小。这表明 TAG 合成以外的机制也可能是造成 LD 尺寸增加的原因。AGPAT2 缺陷细胞中全细胞 PA 的增加已有多个报导,PA 的这种增加可能支持在 AGPAT2 缺陷细胞中形成大的 LD。为了检验这种可能性,研究人员过度表达了 seipin、CDS1 和 CDS2。过表达这三种基因中的任何一种都会减少细胞 PA,并且几乎完全消除了 AGPAT2 缺陷细胞中超大 LD 的形成。总之,这些结果表明,增加的 PA 至少是 AGPAT2 缺陷细胞中异常 LD 形成的部分原因。 通过减少 PA 可以挽救 AGPAT2 缺陷细胞中的超大 LDs 在检查 CDS1/CDS2 表达对 AGPAT2 缺陷细胞中 LD 形成的影响时,研究人员注意到 CDS1/2 的荧光强度,而不是 seipin,在 AGPAT2 缺陷细胞中比 WT HeLa 细胞弱得多(上图,红色荧光)。研究人员在 Huh7 细胞中进一步验证了这一观察结果。AGPAT2 缺陷细胞中 mCherry-CDS1/2 信号的丢失表明 CDS1/2 蛋白质量和活性可能降低。这可以解释 AGPAT2 缺陷细胞中 PA 增加的原因,因为已知 CDS1/CDS2 缺陷会导致 PA 和巨大 LD 的积累。因此,研究人员检查了 WT 和 AGPAT2 缺陷细胞中 CDS1 和 CDS2 的量。与成像结果一致,在 AGPAT2 缺陷细胞中 HA-CDS1 和 -CDS2 均减少。此外,AGPAT2缺陷的Huh7细胞中内源性CDS2蛋白的量显着减少。与蛋白质表达的降低一致,相对于对照细胞,AGPAT2 缺陷细胞中的 CDS 活性降低了约 30%。此外,过表达 AGPAT2、CDS1 或 CDS2 会增加 CDS 活性。 研究人员进一步探究在AGPAT2 缺陷下 CDS1/2 丢失的的原因,结果发现,AGPAT2 和 CDS1/2 物理相互作用并形成复合物,并促进其稳定性/活性。AGPATs 产生的 PA 是磷脂和 TAGs 合成中的关键分支点代谢物,研究人员随后使用13C-油酸作为示踪剂进行了代谢通量分析,发现敲低 AGPAT2 将油酸掺入 PI 减少了 1.7 倍,并在较小程度上减少了掺入 PG,而掺入 TAG 增加了约 40%。相反,过表达 AGPAT2 会增加油酸掺入PG(约 100%)和 PI(约 30%),并将通向 TAG 的通量减少3.3倍。表明AGPAT2 和CDS1/2形成的功能性复合物促进 PA 沿着磷脂合成的 CDP-DAG 途径进一步转化。 最后,为了证关于AGPAT2和CDS1/2在体内的特异性功能联系的发现,研究人员通过CRISPR/Cas9介导的基因编辑产生了肝脏特异性AGPAT2基因敲除小鼠(A2LKO小鼠)。与体外实验的数据一致,AGPAT2缺陷的肝脏在体内也降低了CDS2蛋白水平和CDS活性,这进一步支持了 AGPAT2 和 CDS1/2 之间的功能关系。 总之,该研究提供了有力的证据,证明了AGPAT2和CDS1/2可以形成稳定的配合物,促进CDP-DAG的合成以及AGPAT2在正常LD形成中的作用。这些结果为甘油-3-磷酸途径的调节提供了重要见解,揭示了AGPAT2缺乏时PA增加的分子基础和脂肪代谢障碍机制,并为PA代谢如何在主要代谢分支点控制开辟了未来的研究途径。