J ADV RES:孔英和孔力团队发现了O-GlcNAc修饰介导水通道蛋白3协调子宫内膜细胞糖酵解并影响胚胎植入
2021年6月,大连医科大学、大连医科大学附属第一医院的相关研究人员在《Journal of Advanced Research》(IF: 10.5)上发表了题为“O-GlcNAc modification mediates aquaporin 3 to coordinate endometrial cell glycolysis and affects embryo implantation”的研究论文,阐释了在代谢紊乱中观察到的不良妊娠结局,并为理解植入过程中子宫内膜内的代谢机制提供了参考。

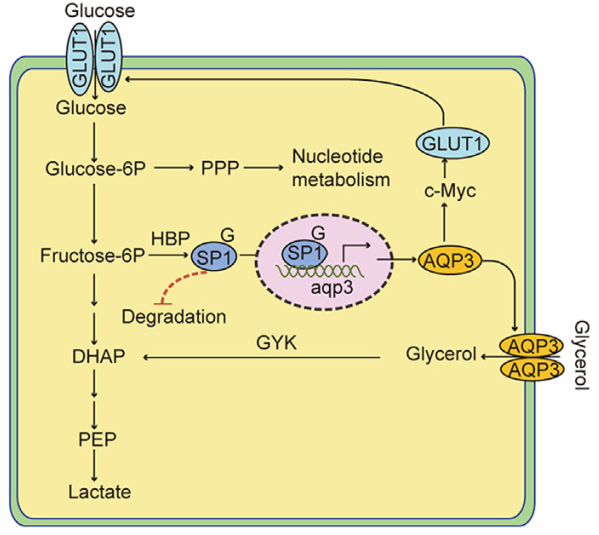
O-GlcNAcylation 影响细胞功能和妊娠结局,在植入窗口期间升高的 GLUT1 通过 HBP 增加 O-GlcNAcylation。
O-GlcNAcylation 通过调节 GLUT1 和 AQP3影响细胞代谢。
AQP3 的表达被 SP1 的 O-GlcNAcylation 上调,SP1 在 S491 位点的 O-GlcNAcylation 影响其稳定性。
O-连接的β-D-N-乙酰氨基葡萄糖(O-GlcNAc)修饰是真核细胞中最丰富的翻译后修饰之一,被认为是将单个O-GlcNAc添加到核蛋白、细胞质蛋白和线粒体蛋白的丝氨酸或苏氨酸残基。迄今为止,仅发现两种酶负责O-GlcNAc的调节OGlcNAc转移酶(OGT),催化O-GlcNAc的增加,以及O-GlcNAcase (OGA),催化O-GlcNAc的水解。O-GlcNAc糖基化修饰(O-GlcNAcylation)通过影响蛋白质转录、定位、相互作用、活性和降解来调节多种途径,从而通过感知广泛的信号来快速和可逆地调节细胞生理。尽管已证明关键蛋白的异常O-GlcNAc酰化会发生在多种疾病中,但很少描述O-GlcNAc修饰在妊娠中的作用。
为了研究O-GlcNAc修饰在妊娠中的可能作用,研究人员收集了人类子宫内膜样本,免疫组织化学结果显示分泌期O-GlcNAc修饰水平较高,此外,O-GlcNAcylation水平的调节显著影响细胞增殖、迁移、侵袭和粘附。O-GlcNAcylation消耗会显著降低胚胎植入率,表明O-GlcNAcylation可能参与胚胎着床过程中的子宫内膜变化。接着,研究人员发现葡糖糖转运蛋白GLUT1在分泌期表达增加,增加的GLUT1通过己糖胺生物合成途径(HBP)促进O-GlcNAcylation水平。
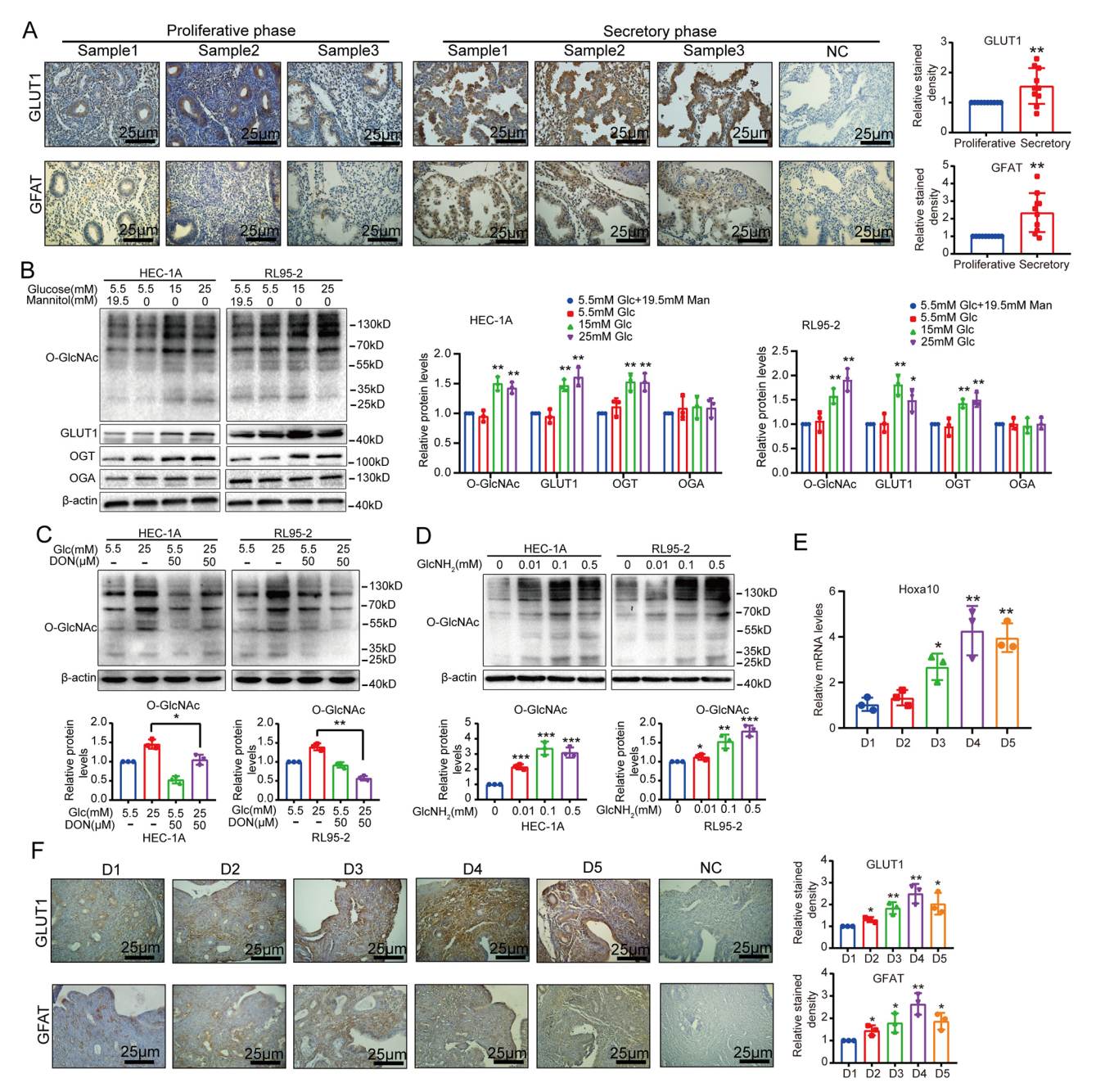
GLUT1和HBP在“植入窗口”期间上调
随后,同位素13C标记的LC-MS分析显示,升高的O-GlcNAcylation影响子宫内膜细胞功能并重定向葡萄糖代谢流,将其分流到戊糖磷酸途径(PPP)和 HBP。此外,糖酵解水平的增加降低了TCA循环,分泌期子宫内膜组织中ATP和乳酸水平的升高增加了着床窗口期Warburg样糖酵解的存在。为了研究O-GlcNAcylation在代谢重编程中的调节途径,研究人员对siOGT处理的细胞进行了转录组测序分析,发现增加的糖酵解水平可以通过GLUT1的O-GlcNAcylation调节增加葡萄糖摄取来实现。水通道蛋白(AQPs)通过介导甘油转运参与能量代谢和组织细胞的增殖,其家族成员中只有AQP3基于测序显着下调,表明AQP3也可能参与了糖酵解的调节。
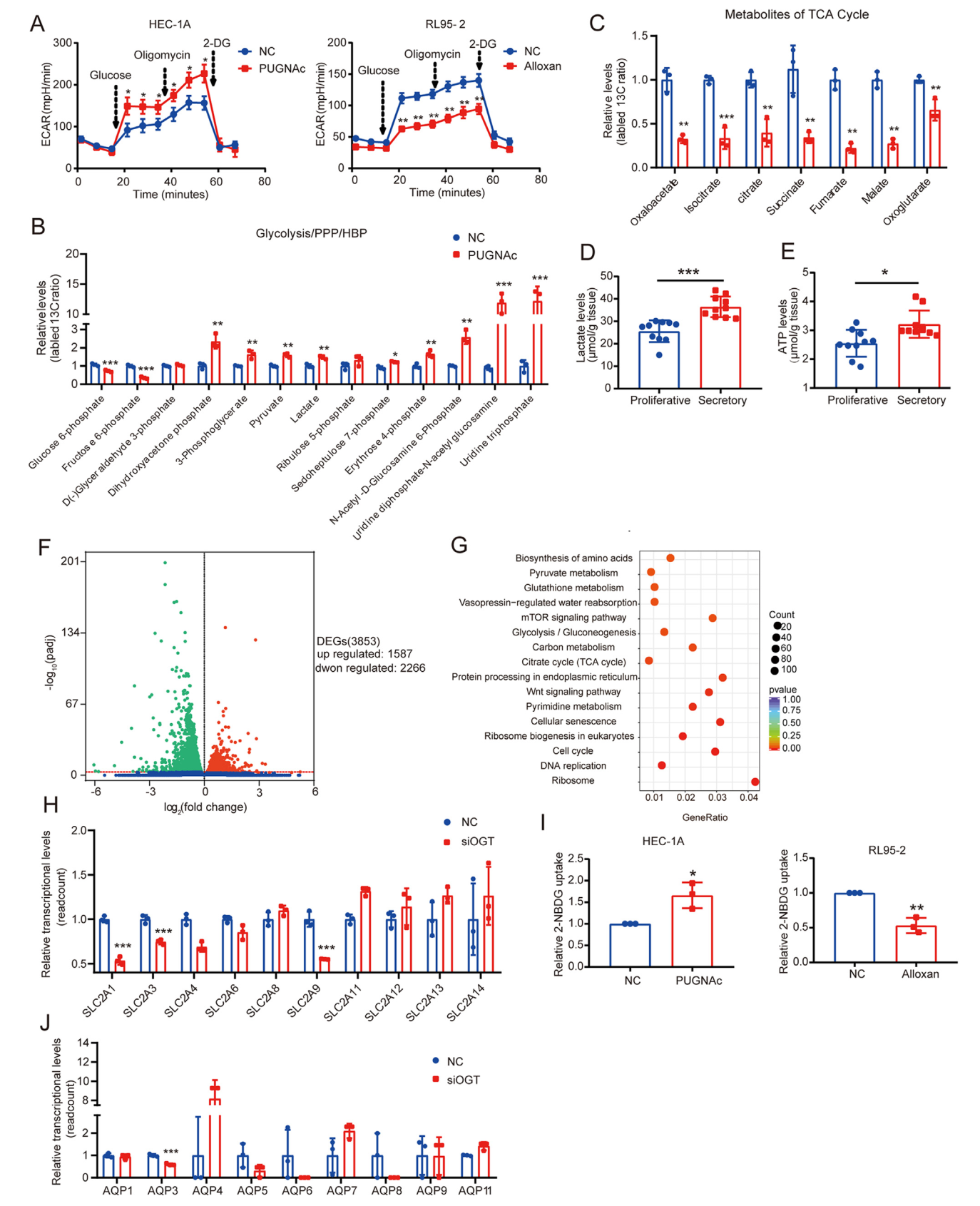
O-GlcNAcylation 水平的调节影响细胞代谢
甘油作为葡萄糖和脂质代谢的重要中间体,其含量在人类子宫内膜组织的分泌期增加。研究人员进一步探究AQP3对糖酵解的影响和甘油的作用,发现AQP3通过甘油的细胞内转运和增加GLUT1表达支持糖酵解代谢,从而为子宫内膜细胞的生理变化提供能量补偿。接着,研究人员用双荧光素酶报告基因检测和染色质免疫沉淀 (ChIP)发现转录因子SP1与AQP3启动子区域特异性结合,SP1 OGlcNAcylation调节AQP3的表达。此外,SP1在S491位点的O-GlcNAcylation影响其稳定性。
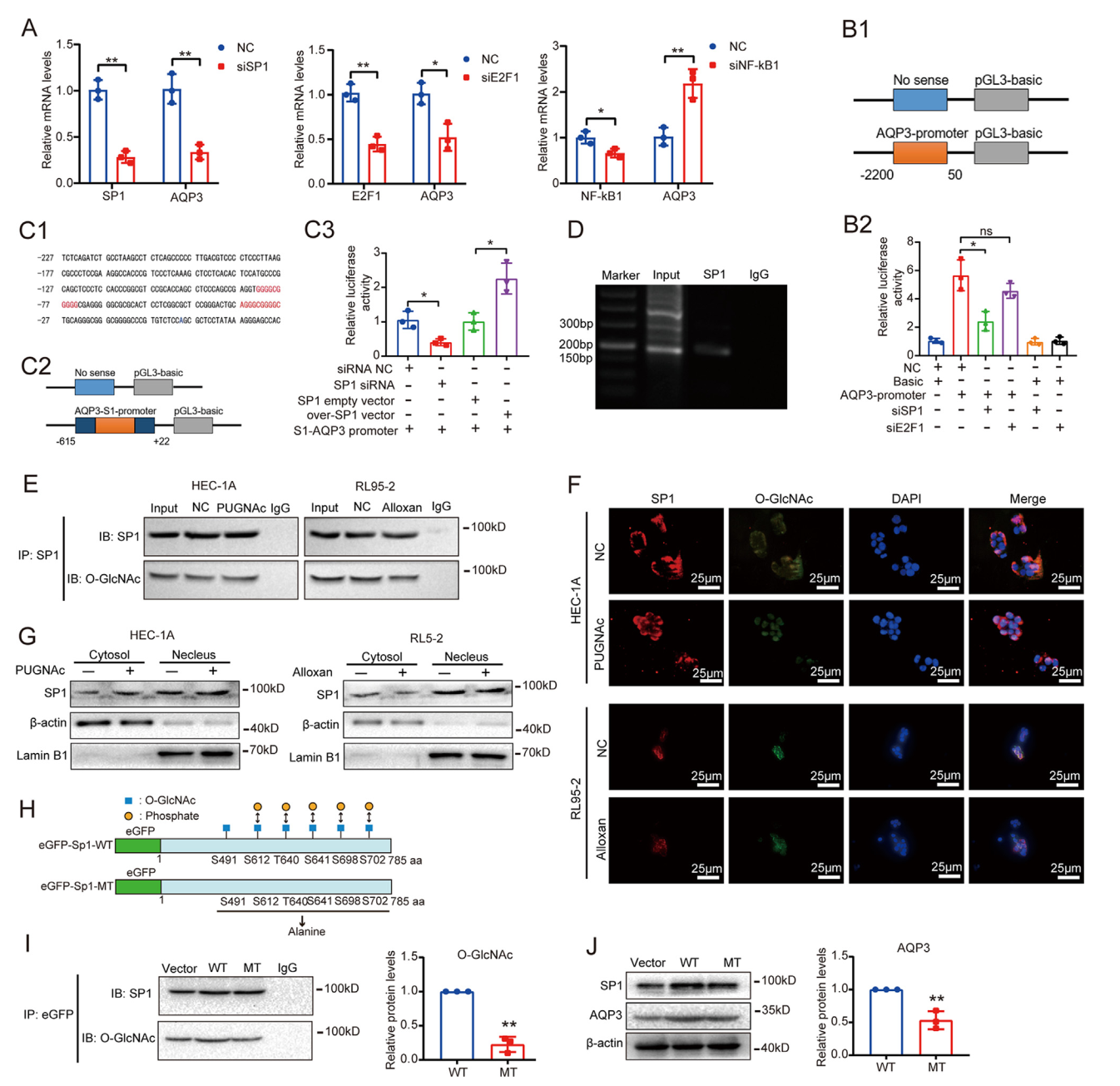
AQP3 的表达被 SP1 的 O-GlcNAcylation 上调
综上所述,胚胎着床过程中子宫内膜的一系列生物学变化与人类生育能力密切相关,而这些变化又依赖于代谢变化。一般而言,O-GlcNAc修饰重新编程代谢以在植入窗口期间向PPP和HBP分流,并通过GLUT1介导的葡萄糖摄入和AQP3介导的甘油细胞内转运补偿糖酵解,从而维持生理需求,调节子宫内膜的接受状态。该研究的结果为影响人类生殖健康的代谢紊乱的发病机制提供了新的见解。