Cell metabolism: 昼夜节律和肠道微生物群使宿主对饮食的代谢反应同步
2021年3月,德克萨斯大学奥斯汀分校等单位的相关研究人员在《Cell metabolism》上发表了题为“Circadian rhythms and the gut microbiome synchronize the host’s metabolic response to diet”的综述论文,概述了昼夜节律、肠道菌群和宿主代谢系统之间的双向相互作用及其对肥胖和能量稳态的影响,并着重指出了未来研究的方向以及利用这些系统来解决代谢疾病的疗法的发展方向。

昼夜节律
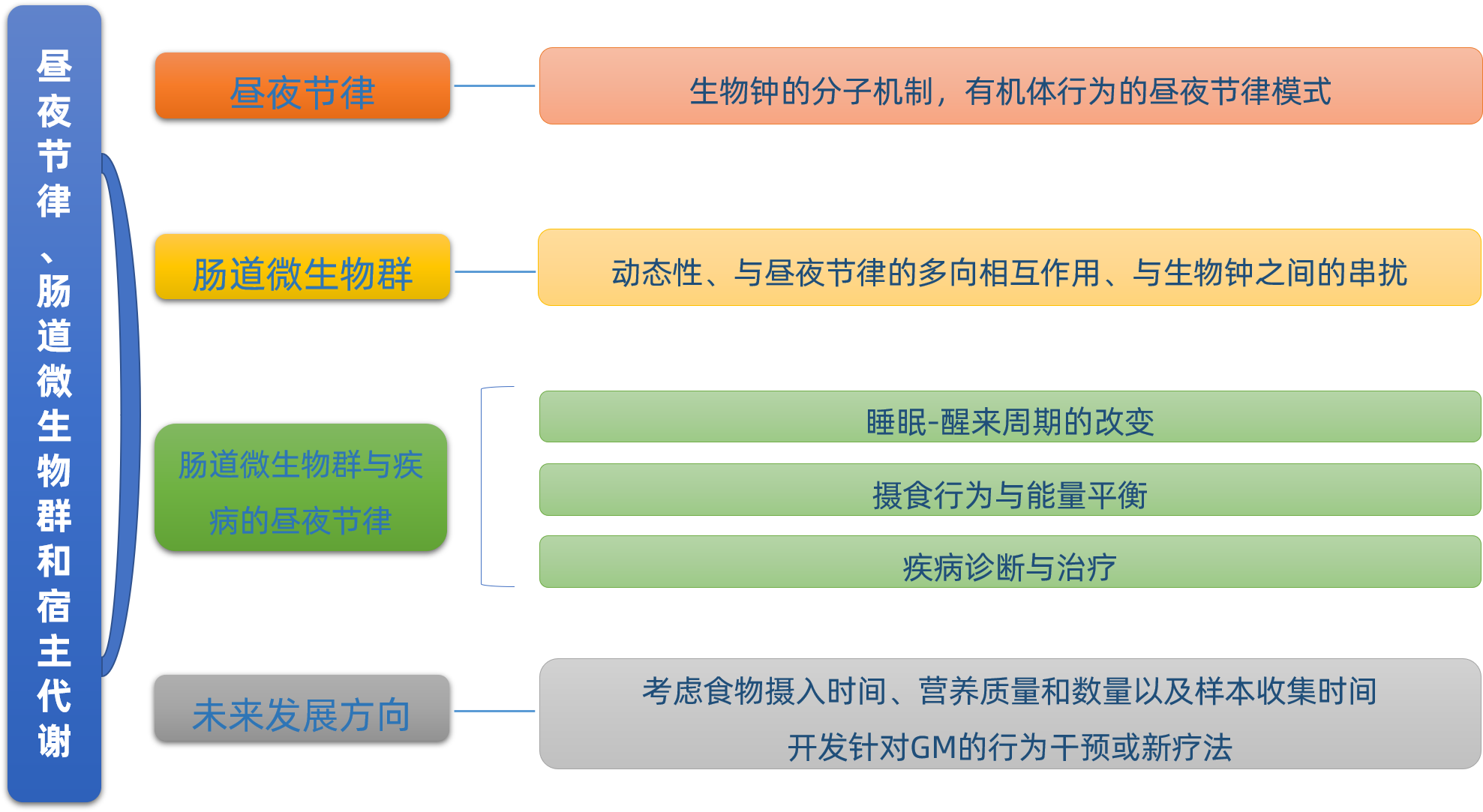
细胞内源性生物钟允许对多种生理过程进行节律控制。哺乳动物生物钟的分子机制(如下图所示)是一种由相互锁定的转录-翻译反馈环组成的自动调节机制。正向系统和负向系统调节细胞生物钟转录元件的节律性表达,进而产生下游生物钟控制基因(CCG)的节律性表达。
调控基因表达的生物钟分子机制
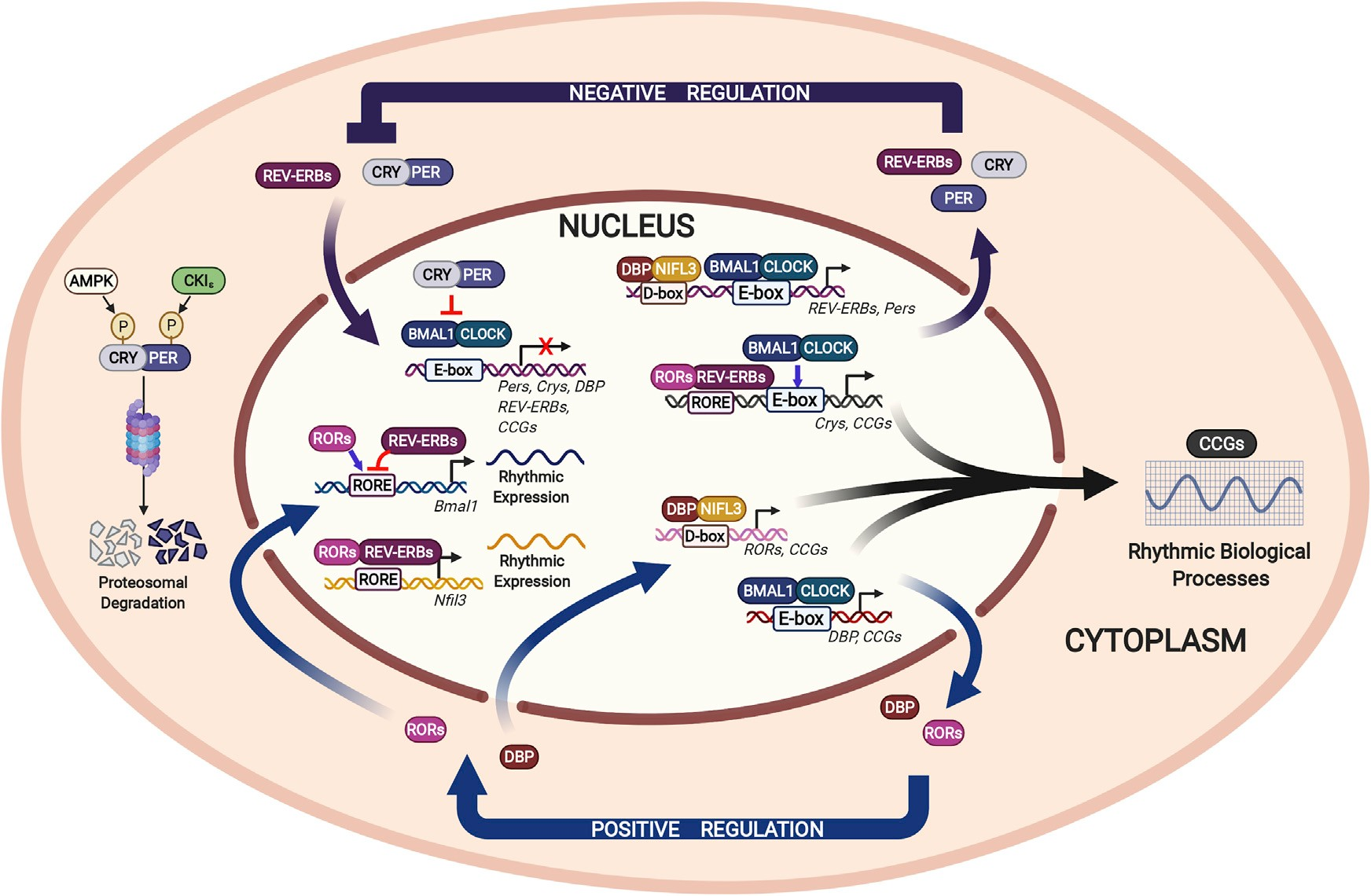
主起搏器或中央起搏器位于大脑下丘脑前部的视交叉上核(SCN),通过刺激视神经(下图)被光/暗(LD)信号授时。SCN时钟通过系统分泌的神经递质向位于其他大脑区域和外周器官的非SCN时钟提供时间信息。
生物钟系统,能量平衡和微生物组
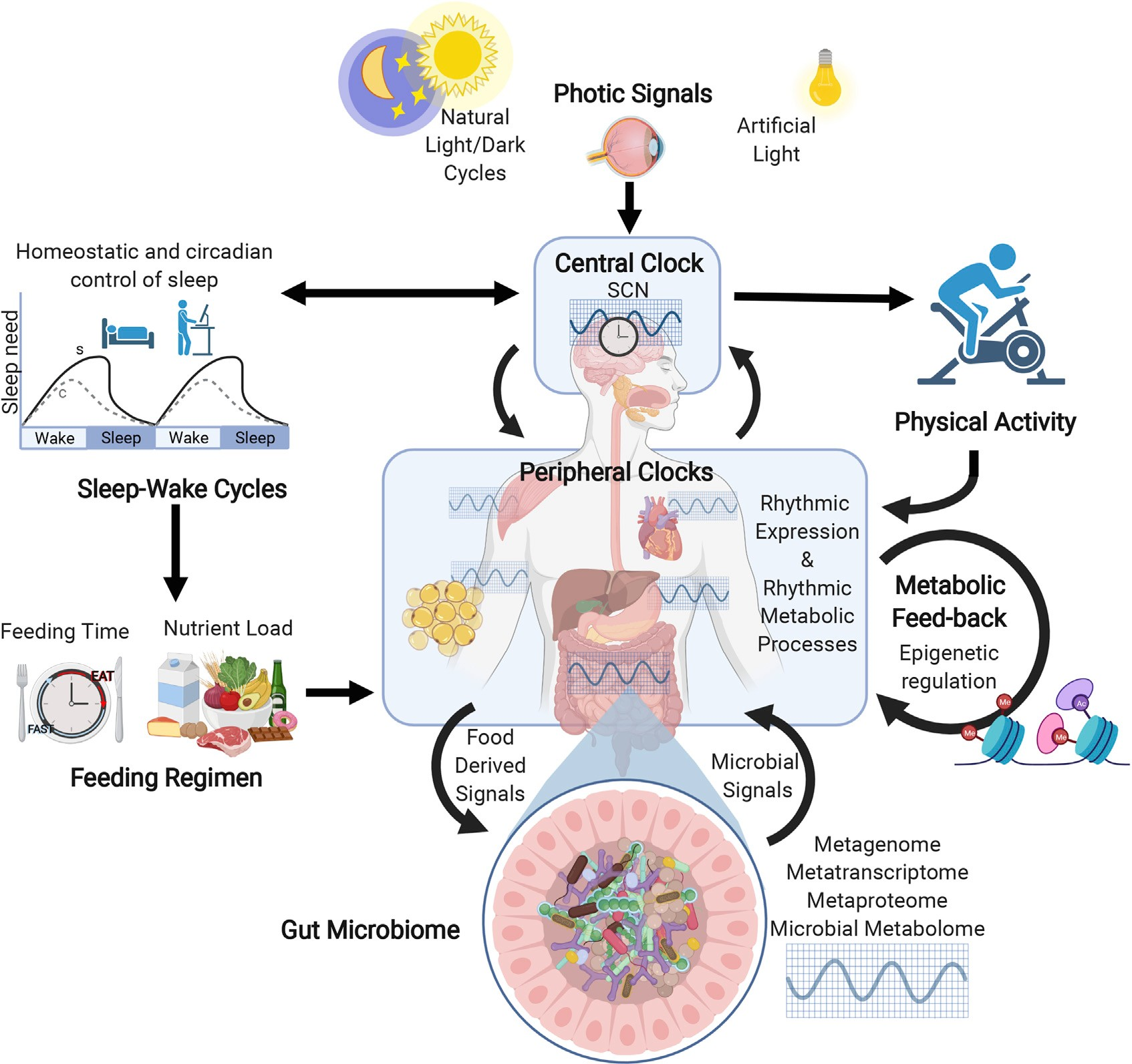
在多细胞有机体中,需要整个有机体协调的行为(例如,唤醒、摄食行为和运动活动)表现出由昼夜节律系统控制的昼夜节律模式,定义了能量摄入和消耗的时间依赖性模式(下图A)。生物钟系统和细胞代谢的不同方面之间存在的层次性和方向性允许最佳的生物钟节律(下图B),通过协调光照、体力活动、摄食行为和睡眠/觉醒周期来达到稳态。昼夜节律紊乱(下图C)发生在睡眠或进食等行为与周围环境(即,黑暗/光明周期)不同步时,影响稳态。越来越多的流行病学证据表明,久坐的生活方式、高脂肪、高碳水化合物、低纤维的西方饮食,以及促进自然睡眠/觉醒周期中断的行为(如轮班工作、长期睡眠限制和社交时差)所有这些都导致了当前全球范围内的超重/肥胖流行、心血管疾病(CVD)和其他代谢紊乱。
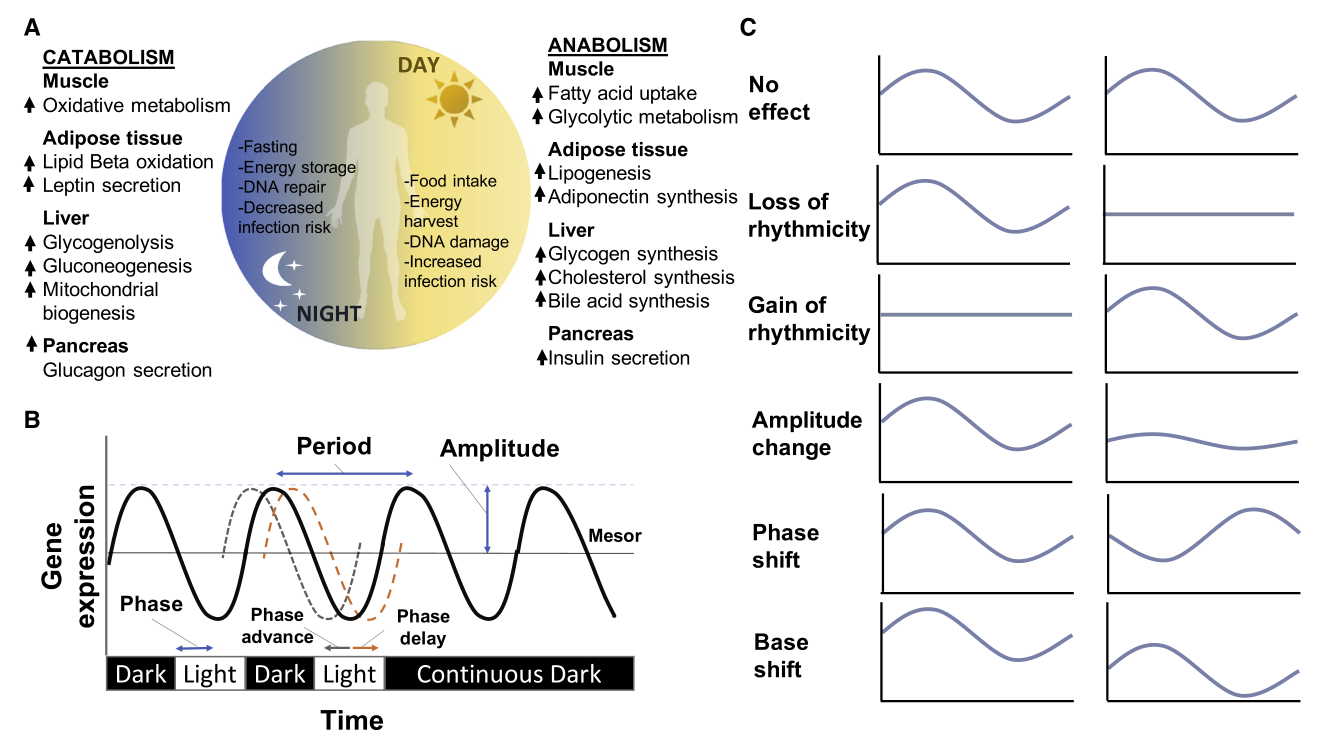
生理和节律参数的昼夜节律分配
肠道微生物群
GM被认为是“微生物器官”和肠内分泌系统的主要组成部分,因为其广泛的代谢能力和对宿主健康和能量稳态的影响(即营养感应、代谢过程、饱腹感和体重调节)。作为对饮食输入的反应,GM的细菌成员通过分泌通常被称为微生物相关分子模式(MAMPs)的代谢物向宿主上皮发出信号,影响宿主的新陈代谢和能量平衡。目前的研究表明,肠道微生物群的组成不仅与宿主代谢活动的变化有关,更重要的是,个别微生物代谢产物可能在正常生理学和疾病发病机制中发挥关键作用。
宿主昼夜节律、营养和代谢信号以及肠道微生物群之间的多向相互作用形成了一个复杂的网络,调节宿主体内的代谢稳态。昼夜节律和GM的紊乱是许多疾病过程的基础,胃肠道微环境在昼夜节律系统的影响下不断变化,胃肠道系统在体内和体外表现出基因表达、分泌和运动的昼夜节律模式。肠道物理环境中的昼夜节律在调节GM丰度和组成方面起着关键作用。胃肠道生理的昼夜节律控制影响细菌生长的时间和营养物质的可用性,间接影响细菌代谢产物的节律和生成。代谢功能的转录调控是连接GM和生物钟的关键因素。
肠道微生物群与疾病的昼夜节律
假设失调期间宿主-GM相互作用的改变是饮食和炎症相关疾病的重要驱动因素,如肥胖、IBS、癌症和CVD。上述多种机制将昼夜节律与GM丰度和功能联系起来,为理解与昼夜节律和GM破坏相关的病理状态的发展提供了一个新的框架。
睡眠时间和结构是由昼夜节律和睡眠稳态过程共同决定的,来自人类和动物昼夜节律紊乱模型的证据有助于确认昼夜节律紊乱、摄食行为和代谢功能改变之间的联系。GM衍生的MAMPs与睡眠行为之间存在相互作用,昼夜节律系统和GM在控制睡眠行为中都扮演着重要的角色。微生物丰度的变化可能参与睡眠结构的调节,并有助于睡眠和代谢相关的病理学。肠道微生物群落组成中的节律振荡依赖于SCN的光刺激,睡眠/觉醒周期有着相互依赖性和强大的GM节律。
饮食衍生的信号(即与能量相关的激素释放和信号通路)可以影响摄食行为模式和时钟基因表达的节律性及其下游靶点,包括代谢基因。与食物摄入相关的生物钟系统的系统性和局部扰动也可能导致慢性代谢疾病的发生。微生物代谢产物可能有助于调节摄食行为,并间接调节生物钟授时。食物摄入的时间会影响微生物组成的每日波动,这是一个灵活的过程,可因摄食行为而丢失或获得,并可能影响宿主基因表达和能量平衡。微生物群落的变化与代谢健康标志物(如体脂百分比)的变化之间的相关性表明,来自微生物代谢产物和宿主昼夜节律系统的信号可能是代谢健康稳态维持所必需的。
在人类中,许多胃肠道疾病,包括胃消化不良、炎症性肠病、肠易激综合征和胃食管反流病,都与昼夜节律的破坏和GM组成的改变有关。考虑到GM成分的日变化与疾病病因之间的紧密联系,GM可能是跟踪人类疾病进展的一个合理的诊断工具。随着我们对转基因、昼夜节律及其对人类健康的单独和综合影响的理解不断发展,基于GM的治疗方法的发展潜力呈指数级增长。开发有效的治疗干预措施,改变复杂的环境,如胃肠道,提出了一个重大的挑战。然而,我们对生物钟及其对宿主代谢功能的影响的分子理解不断增加,这为药物/治疗的发展开辟了新的领域,生物钟系统是一个关键因素。在不久的将来,减少代谢性疾病流行的关键可能在于药物治疗或饮食干预,这些药物或饮食干预旨在战略性地调节GM,以尽量减少慢性昼夜节律紊乱的影响。
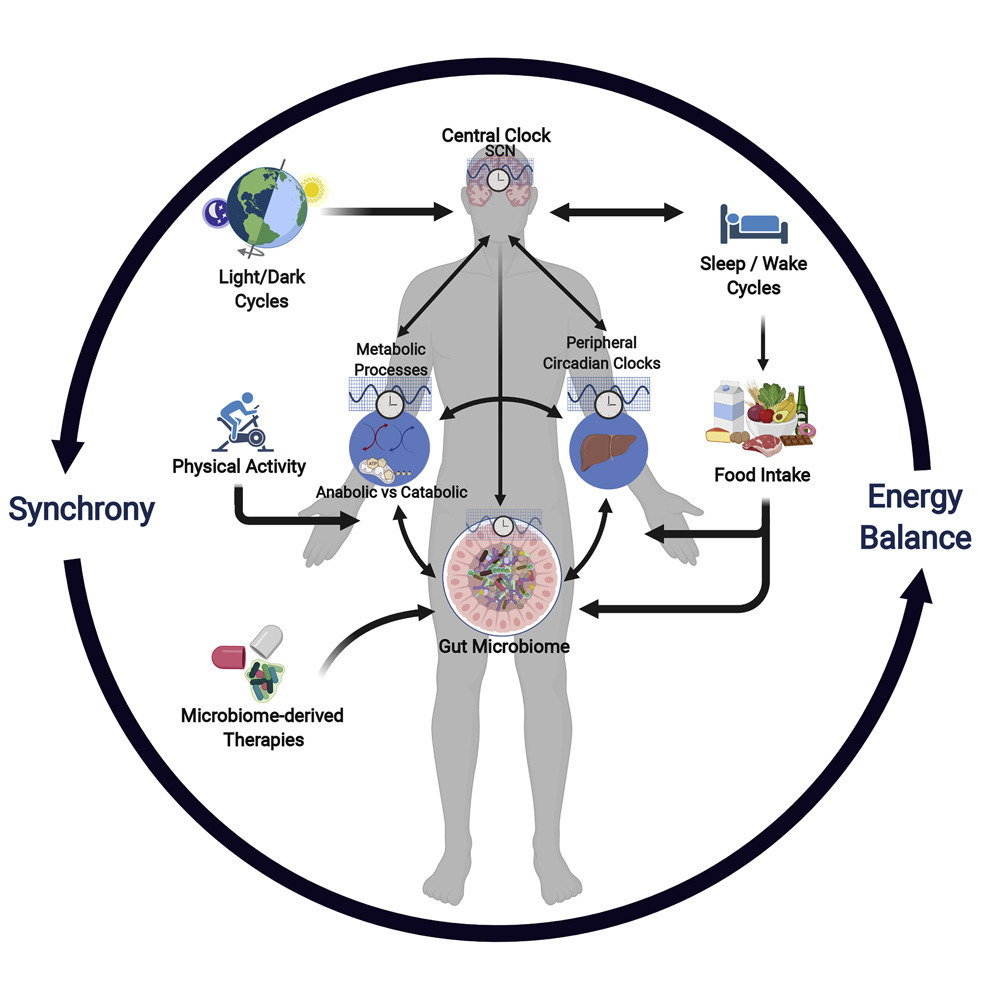
未来发展方向
我们已经开始了解进餐时间和大量营养素负荷对行为和生理过程同步的影响,包括宿主、GM和下游代谢效应之间的相互作用。饮食、昼夜节律系统和GM之间的相互作用突出了GM研究设计和数据收集中时间相关框架的重要性,以便得出营养或药物干预对健康影响的因果结论。为制定有效的治疗干预措施并对其效果进行精确评估,应考虑食物摄入时间、营养质量和数量以及样本收集时间。所需工作的要求是有机会开发针对GM的行为干预或新疗法,以治疗各种疾病,包括癌症、心血管疾病、肥胖症和糖尿病。





