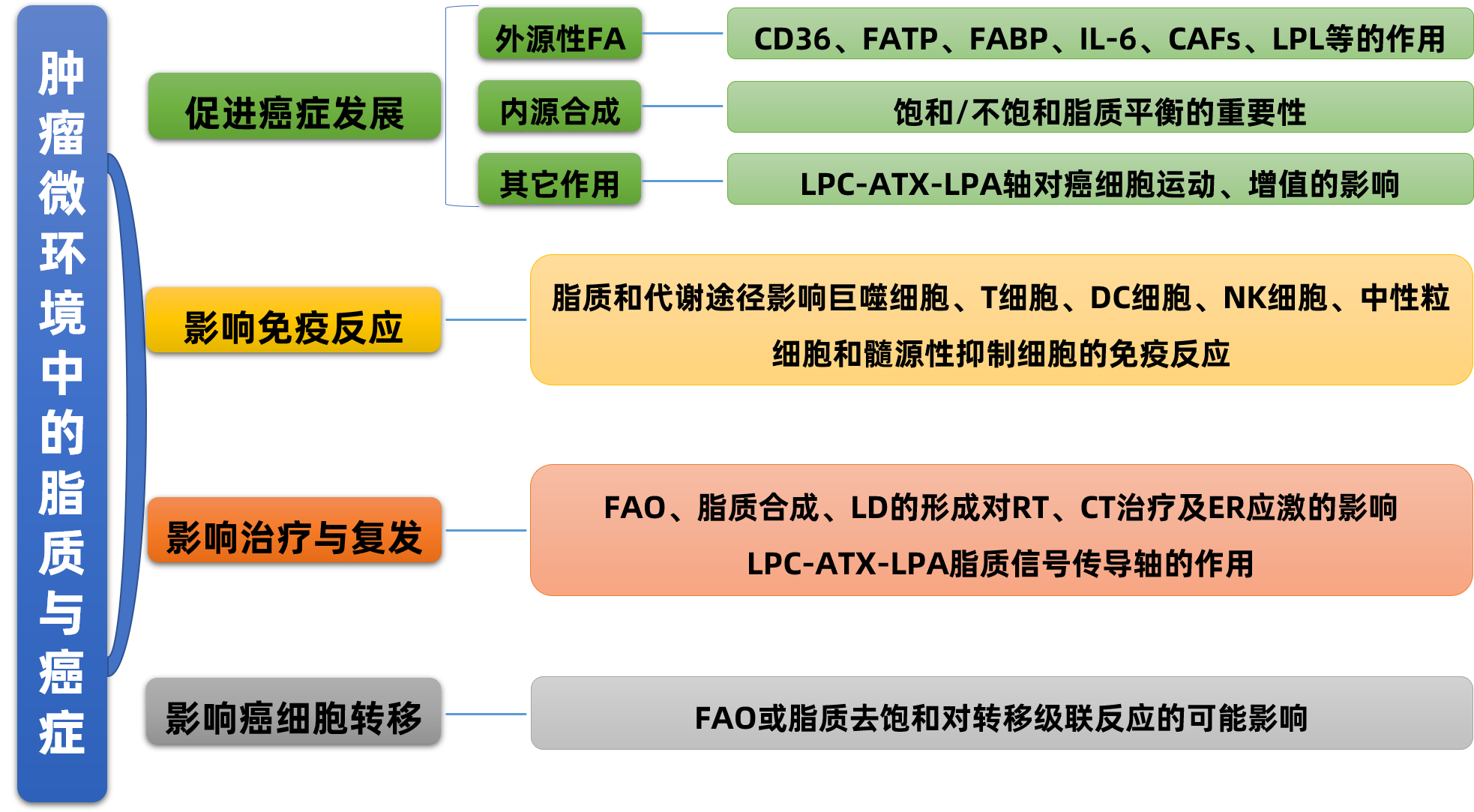
Progress in Lipid Research : 从癌症进展到治疗深入解读肿瘤微环境中的脂质
2020年8月,美国范德堡大学的相关研究人员在《Progress in Lipid Research》(IF: 15.08)上发表了题为“Lipids in the Tumor Microenvironment: From Cancer Progression to Treatment”的长篇综述,深度总结了肿瘤微环境中的脂质对癌症的发展、免疫反应、治疗与复发以及癌细胞转移方面的影响,展示了围绕脂质代谢和信号通路进行癌症治疗干预的重大潜力。

摘 要
在过去的十年中,关于癌细胞代谢异常的研究急剧增加。癌细胞可以在具有挑战性的环境中生长,无论是低氧和营养缺乏的肿瘤微环境,还是转移后的远处组织。癌细胞利用脂质的方式通常受肿瘤微环境和邻近基质内复杂相互作用的影响。脂肪细胞可以被癌细胞激活,脂解甘油三酯,将分泌的脂肪酸输送到癌细胞,癌细胞通过大量的脂肪酸转运体摄取。癌症相关的成纤维细胞也参与脂质的分泌,导致癌细胞分解代谢和脂质信号传导,从而激活有丝分裂和迁移途径。由于这些肿瘤间质相互作用在肿瘤进展过程中加剧,分泌到微环境中的脂肪酸可以影响浸润免疫细胞的功能和表型。脂质代谢异常,例如增加的脂肪酸氧化和从头合成脂质,可以为肿瘤提供生存优势,抵抗化疗和放射治疗,并减轻转移级联反应所涉及的细胞应激。在这篇综述中,我们强调了最近的文献,这些文献证明了脂类如何影响癌症生命周期的每一部分,并表明围绕脂质代谢和信号通路进行治疗干预有着重要的潜力。
1. 引言
了解脂质,其代谢和相关信号之间的相互作用至关重要。脂质不仅包含各种生物分子,其组成和功能各不相同,从脂肪酰、甘油磷脂和鞘脂到固醇和孕烯醇酮脂,而且在癌症中也起着普遍作用——它们构成了细胞器和细胞器的物理屏障,保护细胞免受细胞外空间的侵害,它们可以用作生物物质生产的底物,也可以储存起来用于将来的氧化,从而为细胞的运动和增殖产生能量,并且它们可以直接与受体结合,从而启动促进细胞生长和迁移的复杂信号通路。脂质过多的积累或饱和/不饱和脂肪酸水平的变化会破坏体内平衡,增强细胞应激反应。然而,脂质代谢和信号转导的改变,最近才被认为是细胞异常生长和癌症进展的标志之一。在癌细胞中,细胞膜磷脂的产生至关重要,必须与其他代谢需求保持平衡。基质侵袭过程中,循环游离脂肪酸(FFAs)和其他脂质分子可能会影响癌细胞,这会大大改变细胞信号传导或为细胞生长提供其他底物。考虑肥胖导致的微环境变化时,这些影响甚至更为重要。在探索脂质在肿瘤微环境(TME)内的影响时,不仅必须考虑癌细胞,而且还必须考虑整个免疫和基质细胞群体。就像癌症发展的每个阶段中细胞代谢的变化一样,TME中的细胞参与者及其相互作用也是复杂而动态的(图1)。
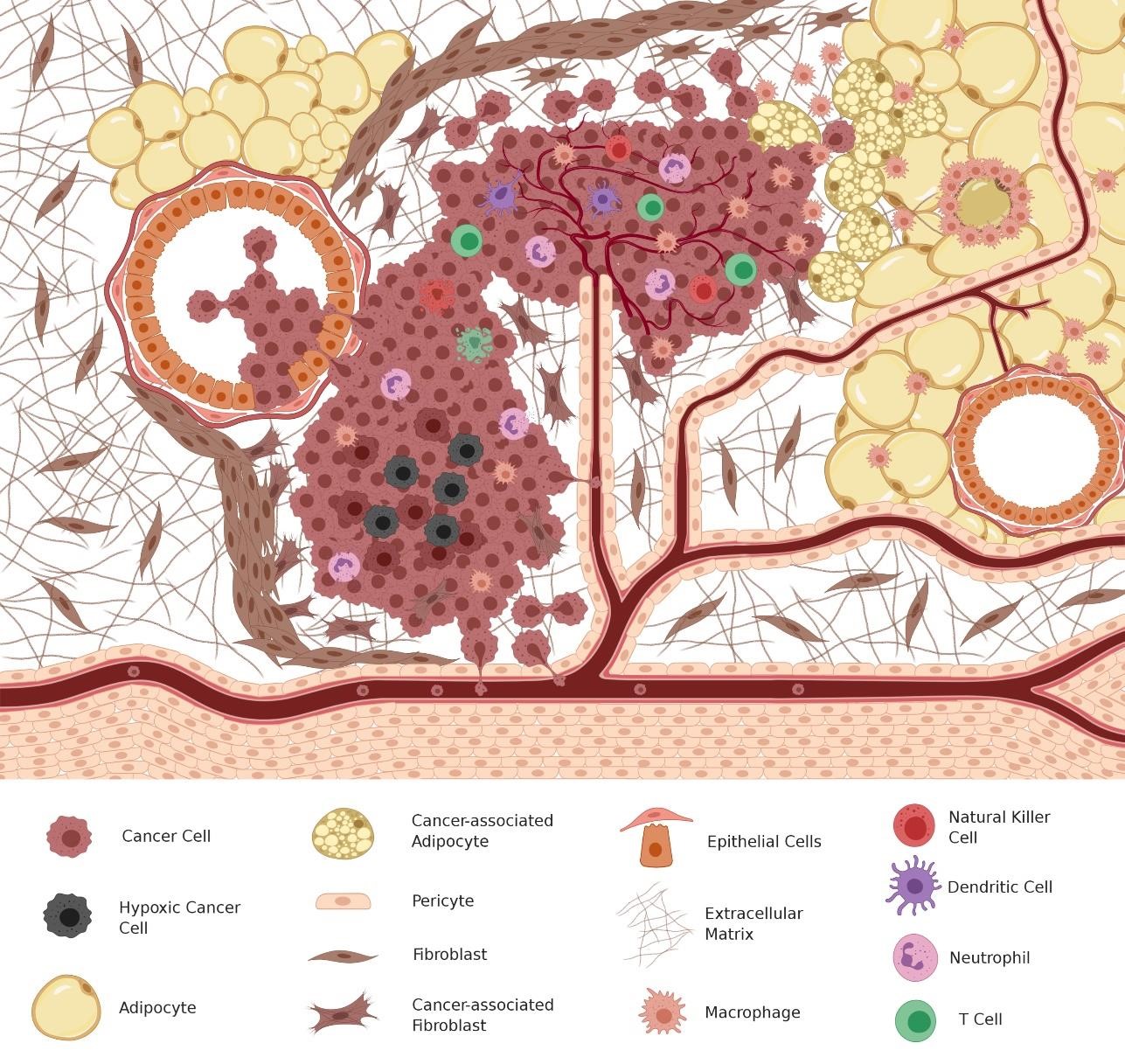
图1. 肿瘤微环境(TME)中的复杂相互作用
了解这些细胞类型如何改变癌细胞的脂质代谢,或者它们如何受到TME内脂质的影响,与研究癌细胞自身的变化以开发更有效的治疗方法一样重要。在这篇综述中,我们探讨了脂质如何通过治疗,复发和转移从癌症进展影响TME的最新进展。我们重点介绍了应进一步评估的领域,以改善治疗效果,提高生存率并防止治疗后的扩散。
2. 肿瘤微环境中的脂质促进癌症进展

图2. 来自TME的外源脂肪酸促进癌症进展和生存
在过去的几年中,受到密切关注的癌细胞的重要代谢标志物与这些细胞从其环境摄取脂肪酸的能力有关。对于在含有大量脂肪细胞或邻近大量脂肪细胞的组织中发展的癌症尤其如此,在肥胖中可能会恶化,因为肥胖通常会增加FFAs的循环。鉴于乳腺癌组织中脂肪细胞的大量存在,乳腺癌是研究外源性脂质对肿瘤进展影响的主要研究领域。然而,其他癌症,包括黑素瘤、胃癌、卵巢癌、前列腺癌和结肠癌,都受到与周围脂肪组织相互作用的影响。许多研究集中在脂肪酸转座酶(也称为CD36)的作用上,CD36是一种膜结合糖蛋白和清除剂,参与将外源脂质输送到细胞质中。此外,例如脂肪酸转运蛋白(FATP)和脂肪酸结合蛋白(FABP)等其它蛋白质也有相关研究。
乳腺癌细胞似乎与脂肪细胞及其脂质存储存在寄生关系。将癌细胞与脂肪细胞共同培养会激活脂肪细胞内的脂解作用,从而将脂肪酸释放到细胞外空间。追踪研究表明,这些脂肪酸被癌细胞吸收,从而导致它们的增殖和迁移增加。乳腺癌细胞对脂肪细胞脂解的反应是增加肉毒碱棕榈酰基转移酶1A(CPT1A)的表达,后者是长链脂肪酸转运到线粒体中进行脂肪酸氧化(FAO)的限速酶。一旦脂肪细胞被癌细胞激活,它们最终将分泌更高水平的促炎细胞因子,包括白介素6(IL-6)。这些促炎细胞因子也被癌细胞分泌,并有助于诱导脂肪酸从甘油三酯存储中释放出来,因为它们被认为是强脂解因子。然而,也有研究表明阻断IL-6并不能阻止脂肪细胞发生脂解反应,提示可能与多种因素有关。IL-6的上调可能会放大两种细胞之间的代谢串扰,IL-6通过STAT3途径传递信号,而CD36最近被证实是STAT3激活的下游靶点,进一步促进癌细胞对脂肪酸的摄取。如果是这样的话,代谢激活的脂肪组织巨噬细胞也能分泌高水平的IL-6,可能在这个轴上发挥作用。
涉及脂肪酸从脂肪细胞向乳腺癌细胞转移的另一种主要的脂肪因子是FABP4,其通常存在于细胞质中并参与细胞器之间脂肪酸的细胞内运输,但也可以被分泌。相反的结果表明,FABP4要么被癌细胞吸收,要么仅与细胞表面的磷脂结合以诱导信号传导事件。无论如何,外源性FABP4均可诱导乳腺癌细胞中脂肪酸转运蛋白CD36和FABP5的表达。FABP4在癌症进展中的作用已远远超出乳腺癌,因为已在急性髓细胞性白血病,非小细胞肺癌,卵巢癌和口腔鳞状细胞癌中发现了FABP4。
肿瘤相关成纤维细胞(CAFs)在TME中诱导上皮间充质转化(EMT)并分泌免疫抑制和促血管生成因子,最近的文献表明它们可能在脂质转运和摄取中发挥作用。CAFs可诱导人MDA-MB-231三阴性乳腺癌细胞中FATP1的上调,导致TME中外源脂肪酸的摄取增加。CAFs还可以通过微泡将脂质转移到癌细胞,这已经被证明可以增加癌细胞的增殖。
脂质的饮食来源是癌细胞获得脂肪酸的另一种途径。利用这些来源涉及脂蛋白脂肪酶(LPL)的表达,该酶水解循环中极低密度脂蛋白(VLDL)中的甘油三酯含量。这些脂肪酸然后可以被CD36吸收。在非小细胞肺癌、肝细胞癌、高级神经胶质瘤和三阴性乳腺癌中,LPL表达和活性的增加已有报道。近来,LPL以非酶促方式促进的完整VLDL的受体介导的内吞作用被证明是乳腺癌细胞中脂质吸收的新方法。这些脂蛋白的内吞作用诱导代谢相关基因表达的改变,从而增加脂质转运和脂滴(LD)形成蛋白。这些研究表明,靶向与脂肪酸摄取有关的转运蛋白可以用来对抗癌症的进展,然而,鉴于细胞可以从细胞外空间利用这些资源的方式多种多样,开发针对这些途径的药物可能具有挑战性。
无论循环中FFAs的浓度和摄取情况如何,癌细胞都具有高水平的从头脂肪生成,这是一个独特的特点,因为除了脂肪组织和肝脏,大多数人体组织的脂质合成很少,脂肪酸合酶(FASN)表达低。除必需的多不饱和omega-3和omega-6脂肪酸外,新合成的脂肪酸还用于生产膜和脂质筏的磷脂,这些脂肪酸从外部获得且不能从头合成。然而,一些研究对合成脂肪酸最终被癌细胞使用的地方提出了质疑,认为新生脂肪酸超出了癌细胞的需要,相反,外源性脂肪酸是细胞膜的来源。两者都可能是真的,可能取决于TME内的条件。FASN负责结合丙二酰辅酶A和乙酰辅酶A来生产饱和脂肪酸棕榈酸酯。高水平的合成棕榈酸盐、对细胞有脂毒性,但是来自外部来源的油酸盐可以减轻棕榈酸盐引起的脂肪毒性。硬脂酰辅酶A去饱和酶1(SCD1)参与单不饱和脂肪酸(包括油酸)的形成,其表达的增加已被证明能促进几种癌症的进展。但是,SCD1的酶活性需要氧气,而在血管化程度低和低氧的TME中可能缺乏氧气。在这种情况下,低氧细胞可能会绕过脂质合成途径,并增加溶血磷脂对外源性不饱和脂肪酸的吸收,而不是游离油酸。在常氧中发生突变以增加脂肪酸摄取和LD合成的突变细胞可以稍后在缺氧期间利用其储备,释放不饱和脂肪酸以平衡饱和水平。除缺氧外,饱和/不饱和脂肪酸可能会影响癌细胞的迁移和侵袭。膜磷脂中较高含量的饱和脂肪酸会增加密度,并降低细胞膜的流动性。不能摄取不饱和脂肪酸或无法合成不饱和脂肪酸的细胞会获得更加圆润的形态,这与膜流动性降低导致方向变化增加和迁移速度降低有关。相反,细胞合成饱和脂肪酸的失败会中断脂筏结构域,干扰侵袭足的形成,减少细胞侵袭。综上所述,在癌症进展过程中,保持饱和脂质和不饱和脂质之间的紧密平衡至关重要。
如果不用于膜合成,合成并储存在LDs中或外源性摄取的脂肪酸可用于FAO促进肿瘤生长。脂肪细胞与该过程有关,可以分泌包含与β氧化有关的蛋白质的外泌体,黑色素瘤细胞可以吸收和利用这些蛋白质,而不会增加这些酶的mRNA水平。在急性髓细胞性白血病细胞中,骨髓脂肪细胞可诱导FAO减少活性氧(ROS)和细胞凋亡。虽然FAO是一种高效的肿瘤细胞ATP生成方式,但脂类可以通过提供能量来源以外的方式影响增殖和迁移。
脂质不仅仅是代谢产物
除了作为膜合成的底物和癌细胞的高能量来源外,脂类还可以在TME中发挥额外的作用。在经历严重的结缔组织增生的肿瘤中,肿瘤周围致密的ECM导致局部血管系统供氧和代谢产物的障碍,使TME相对缺乏营养。这种情况发生在胰腺导管腺癌(PDAC)中,癌细胞以溶血磷脂酰胆碱(LPC)及其水解产物溶血磷脂酸(LPA)的形式从CAFs中清除脂质分子。PDAC细胞可以将CAF分泌的LPC掺入新合成的膜中。但是,CAF分泌的自分泌运动因子(ATX)将LPC水解为LPA,可以用作促有丝分裂和迁移信号分子。当探索该LPC-ATX-LPA轴在体内的影响时,与仅注射PDAC细胞相比,当将PDAC细胞与CAFs共注射到胰腺中时,在抑制ATX时观察到肿瘤生长的显着减少。这些结果进一步强调了肿瘤相关基质细胞在基于脂质的肿瘤进展中的重要性。
肿瘤相关基质细胞分泌的促炎性细胞因子可诱导肿瘤细胞表达ATX。在胰腺神经内分泌肿瘤中,IL-6激活STAT3,导致ATX表达增加。激活的STAT3还与乳腺癌细胞中ATX表达增加和迁移能力增强有关。其他文献表明,乳腺癌受LPC-ATX-LPA轴高度影响。但是,与胰腺癌相似,与乳腺癌细胞本身相比,乳腺组织微环境中的基质细胞(如脂肪干细胞和脂肪细胞)可产生大部分ATX。癌细胞的分泌因子可能进一步增加这些基质细胞中ATX的表达,因为与正常健康的乳房脂肪组织相比,这些细胞类型在患有肿瘤的患者中表达更高水平的ATX。ATX将LPC转化为LPA以及由此产生的信号传导似乎在所有进展阶段都影响乳腺癌的增殖。在正常乳腺上皮、原位癌和侵袭性雌激素受体阴性细胞系中,已观察到LPA浓度升高,细胞凋亡减少。在这三种细胞系中,正常上皮细胞分泌的ATX水平高于进行性更高的恶性细胞,这表明在原位生长的初始阶段,ATX和LPA可能起作用。尽管ATX分泌较低,但LPC暴露仍会在浸润性细胞系中导致最高的增殖,表明该磷脂可能通过其他信号级联反应改变增殖。无论如何,在三阴性乳腺癌的同基因模型中,ATX抑制作用可以减少初始肿瘤的生长。当细胞开始侵入周围组织时,ATX抑制不再对原发性肿瘤的生长产生显著影响,然而,破坏LPC-ATX-LPA轴有助于减少肺部形成的转移性结节的数量。
ATX、LPC和LPA作为重要的代谢和信号分子在其他多种来源的癌症中的作用仍在研究中,包括多形性胶质母细胞瘤、肾细胞和膀胱癌、甲状腺癌、结直肠癌和卵巢癌。最近关于LPC-ATX-LPA轴和癌症进展的文献集中在六个LPA受体(LPAR)如何在癌细胞迁移、增殖和转移潜能中扮演相反的角色。在卵巢癌中通过LPAR1和LPAR2进行LPA信号传递以及在胰腺癌中通过LPAR6进行LPA信号传递后,观察到迁移增加。此外,在结肠癌中通过LPAR4和LPAR6,在黑素瘤中通过LPAR2和LPAR5以及在胰腺癌中通过LPAR4和LPAR5进行LPA信号传导后,癌细胞运动性降低。虽然LPA信号通过LPAR5降低了黑色素瘤细胞的运动性,但LPAR5在小鼠体内的敲除减少了肺转移,这表明基质细胞或免疫细胞上的这种受体在防止黑色素瘤扩散到其他器官中的重要性。今后的工作将有必要建立LPAR在各种癌症类型中的表达模式。评估LPA信号对癌细胞运动和增殖的影响还必须与研究对基质细胞的影响相结合,以便更好地了解如何针对脂质信号轴来改善患者的预后。
3. 脂质代谢和对肿瘤进展的免疫反应
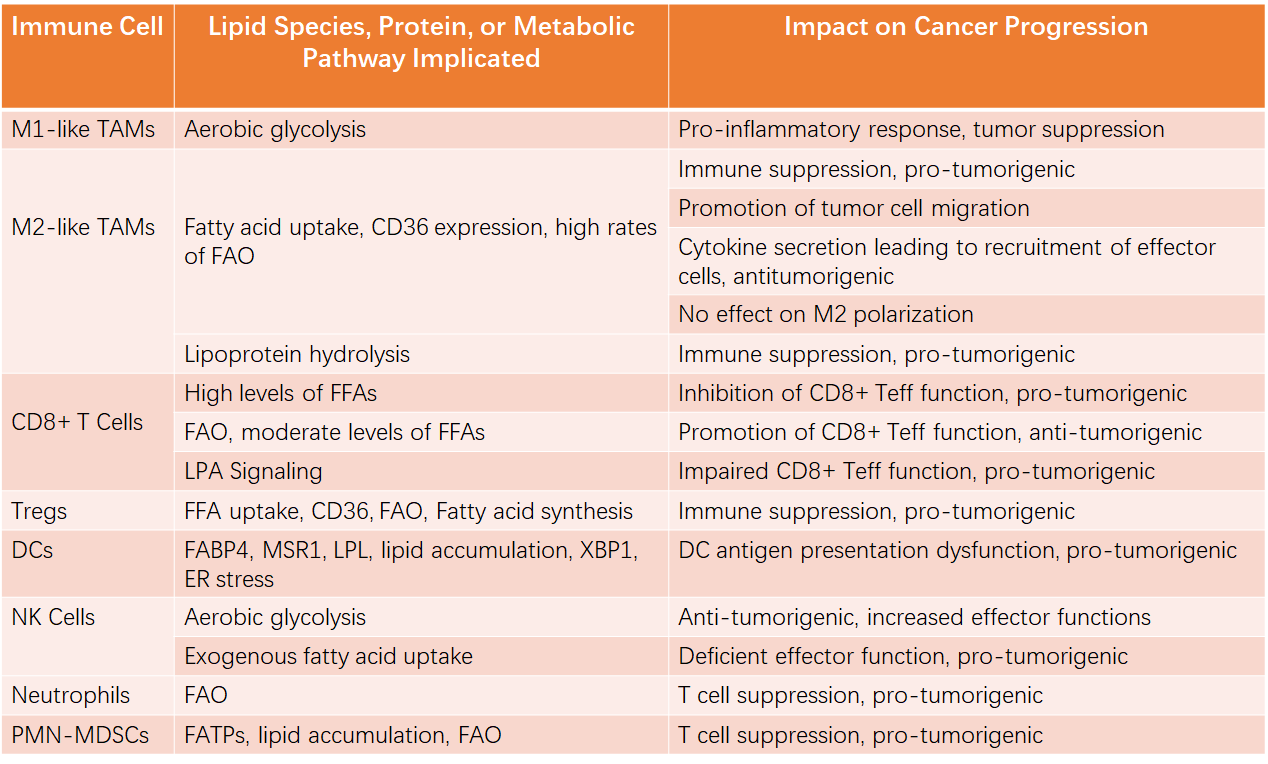
先天免疫和适应性免疫的细胞可以对生长中的肿瘤作出反应,并引发促炎性反应,以帮助清除癌细胞或屈服于来自TME的抑制信号,最终帮助肿瘤的发展。在这里,我们讨论了这些免疫细胞的代谢状态及其在TME中对脂质的使用如何影响其功能。表1总结了每种免疫细胞类型的主要脂酶和途径。
表1. 脂质和代谢途径影响免疫反应和肿瘤进展
巨噬细胞
在招募到TME的所有免疫细胞中,巨噬细胞可占某些癌症细胞总数的一半以上,并与癌症进展的每个阶段都有牵连。浸润的巨噬细胞可能起抗肿瘤作用,但倾向于适应TME中具有抗炎和促肿瘤作用的巨噬细胞。大多数文献都将巨噬细胞作为两种表型中的一种进行讨论——经典激活的促炎性M1巨噬细胞或另一种激活的抗炎性促肿瘤M2巨噬细胞。尽管这种二分法过分简化了巨噬细胞的复杂和动态行为,特别是对于M2巨噬细胞,因为现在人们已经认识到有许多功能和特征上不同的亚型,但这些分类对于表征其在癌症中的作用仍然有用。M2表型的肿瘤相关巨噬细胞(TAM)可以刺激血管生成,增强肿瘤细胞的侵袭和外渗并抑制T细胞活化和对恶性细胞的效应器功能。大量存在的M2样TAM与多种癌症类型(包括乳腺癌,非小细胞肺癌和前列腺癌)中肿瘤大小增加、增殖增加以及总体存活率降低有关。了解抗炎性TAM的代谢结构以及它们与促炎TAM的区别有助于推动治疗方法的发展,这些方法可以重新编程TAM表型,将一种“寒冷”的免疫抑制型TME转变为可以被免疫系统挑战的TME。
当巨噬细胞向M1表型极化时,它们利用有氧糖酵解作用,类似于癌细胞中的Warburg效应。与线粒体的生物发生相比,从氧化磷酸化到有氧糖酵解的转变发生得很快,并使糖酵解中间体穿梭进入戊糖磷酸途径(PPP),产生NADPH以产生ROS的NADPH氧化酶。相反,TAMs向M2表型的极化通常被认为是FAO增加的标志,因为它们暴露于TME内癌细胞分泌的脂肪酸。然而,最近的文献表明,简单地阻断脂肪酸的摄取和氧化,以治疗性地诱导TAMs中M2到M1的转换将大大简化TAM极化的代谢性质。饱和脂肪酸和不饱和脂肪酸的哪一种确切组合对M2极化至关重要,以及是否需要循环脂蛋白而不仅仅是FFAs的全部水解产物尚未完全阐明。不管来源如何,CD36似乎是免疫抑制TAMs的一种活性转运体,研究表明这些细胞增加了脂质积累,FAO是小鼠和人类巨噬细胞免疫抑制活性所必需的。相反,一些人认为FAO对于M2样巨噬细胞是不可或缺的。在其他巨噬细胞亚群中,尽管与M2表型相关,但脂肪酸摄取和氧化增加可能是这些细胞分泌促炎性细胞因子(例如CXCL10,IL-1β和IL-10)的原因,它们可能具有通过增加效应T细胞和自然杀伤(NK)细胞的募集或诱导肿瘤细胞迁移的竞争性下游效应。在针对这些途径的治疗有效之前,需要进一步的研究来确定类M2 TAM如何利用微环境和FAO中的脂肪酸。
T细胞
T细胞在免疫中扮演着重要的角色,包括对癌症的反应。CD8+ T细胞浸润肿瘤与患者阳性结果相关,因为肿瘤特异性抗原识别允许CD8+效应T细胞(Teffs)通过穿孔素、颗粒酶和其他效应分子破坏癌细胞。CD4+T细胞在癌症中的作用更为复杂,可分为抗肿瘤和促炎性T-helper1(Th1)细胞、免疫抑制性T-helper2(Th2)细胞、模棱两可的T-helper17(Th17)细胞或免疫调节性T细胞(Tregs)。T细胞的浸润和功能对于减缓肿瘤的生长和进展至关重要,这可能是一种治疗方法。
CD8 + Teff通常以利用好氧糖酵解维持效应子功能为特征。但是,这可能会受到挑战,具体取决于TME内的养分利用率。来自循环系统或TME内部的FFAs浓度增加与CD8 +细胞毒性T淋巴细胞活性降低相关。然而,其他研究讨论了促进脂肪酸响应的效应器。随着肿瘤在快速增殖和生长过程中由于葡萄糖耗尽而导致营养缺乏的区域,肿瘤浸润淋巴细胞(TIL)依赖于氧化磷酸化(OXPHOS)来维持能量水平和效应器功能。当氧气供应受限时,缺氧诱导因子-1α(HIF-1α)表达增强糖酵解。氧气和葡萄糖的缺乏可能会进一步改变TIL的代谢状况,从而增加脂肪酸摄取和分解代谢以维持效应器功能,而FAO和酮体代谢之间的平衡取决于缺氧的程度。有趣的是,与常氧性疾病相比,低氧增加了CD8 + T细胞介导的肿瘤排斥反应。其他研究表明FAO的效应器功能增强,但这些结果可能不能完全归因于FAO,因为糖酵解也被上调。相反,肥胖驱动的瘦素/STAT3信号在乳腺癌中促进FAO和减少糖酵解,抑制效应器功能和促进肿瘤生长。尽管关于脂肪酸的作用及其分解代谢存在矛盾的结果,但它们促进或抑制CD8 + T细胞效应器功能的条件取决于环境。为了利用基于代谢的疗法来根除肿瘤,必须进行进一步的研究以确定脂肪酸何时对效应器功能有害。这在脂肪丰富的环境中发展的肿瘤尤其重要,例如乳腺癌,前列腺癌,结肠直肠癌和卵巢癌。
尽管Th2细胞与免疫抑制伤口愈合功能相关,但与免疫抑制最相关的CD4 + T细胞亚型是Treg,它抑制T细胞活性。Treg是表达FoxP3的CD4 + T细胞,FoxP3是Treg发育和功能的主要调节因子,可改善脂肪酸摄取、OXPHOS和FAO的功能。FoxP3增强了Treg对脂毒性环境(如TME)的抗性,而无需牺牲糖酵解来扩张。Treg已被证实可浸润肿瘤,对患者的预后反应较差。通过抑制细胞毒性活性,通常认为Treg在肿瘤细胞的免疫逃逸中起作用,并可能支持其他类型的肿瘤细胞,例如M2巨噬细胞。渗透到TME中的Treg不仅具有高度抑制性,而且糖酵解速率和脂质生物合成能力增强,同时仍然比常规Treg更加依赖FAO。在缺氧环境中,Treg利用细胞外FFAs支持CD8 + T细胞的抑制,这使其比TME相关的Teff具有优势。虽然这些发现在脂质吸收与合成之间似乎是矛盾的,但有学者假定Tregs根据营养素的利用来充分调节其新陈代谢。
CD36介导的代谢适应还可以支持肿瘤内Treg,使它们能够改善线粒体适应性和生物发生、存活并利用高乳酸环境,同时还具有上述优越的抑制功能。在黑色素瘤癌细胞条件培养基的存在下,Treg不仅上调CD36,而且抑制CD36足以减少肿瘤内Treg的数量并抑制功能。由于过氧化物酶体增殖物激活受体(PPAR)信号有助于代谢调节,因此PPARβ在CD36介导的肿瘤内Treg抑制活性的增加中必不可少。总之,在TME中靶向T细胞代谢可能会导致癌症免疫疗法的改善。
然而,在T细胞效应器功能中考虑脂质的重要性超出了对其代谢的理解。最近的研究进一步强调了LPC-ATX-LPA轴在T细胞中预防肿瘤免疫逃避的治疗潜力。大多数关于LPA信号传导影响的研究集中于原始T细胞归化到次级淋巴器官,其中ATX从高内皮小静脉或基质细胞分泌。ATX作用于血清LPC,产生通过LPAR2发出信号并促进T细胞运动的LPA。这表明,考虑到许多不同癌症类型的实体瘤都含有支持淋巴细胞浸润的血管(包括高内皮小静脉),LPA信号传导可能会改善针对肿瘤的免疫反应。但是,其他研究表明,当LPA通过LPAR5在T细胞中传递信号时,T细胞的细胞毒性就会减弱。这些研究为靶向LPAR5提供了潜在的治疗途径,可防止肿瘤免疫逃逸。
树突状细胞
树突状细胞(DC)在介导抗原呈递给T细胞时,对适应性免疫反应至关重要。因此,了解它们的功能障碍可以阐明TME中无效免疫细胞反应的原因。当未成熟的树突状细胞依赖线粒体的生物发生时,toll样受体(TLR)刺激后的激活过程增加了糖酵解和脂肪酸合成,长期存活的典型代表是糖酵解增加和OXPHOS减少。肿瘤相关DCs中LDs内脂质积累的增加通过减少抗原呈递导致DC功能障碍,并导致T细胞反应的刺激性差。靶向巨噬细胞清除受体(MSR1或CD204),乙酰辅酶A羧化酶(ACC)或X-box结合蛋白1(XBP1)消除了与肿瘤相关的DCs增加的脂质蓄积,从而提高了临床前模型的存活率。由于尚未完全了解有关脂质如何影响DCs的完整机制,对脂质-DC相互作用的进一步研究可能会产生使DC抗原呈递功能恢复活力并可能增强抗肿瘤免疫应答的治疗方法。
自然杀伤细胞
NK细胞是先天性免疫反应的第一反应者。它们在TME中的招募是由促炎性细胞因子促进的,在那里它们可以被激活以招募更多的免疫细胞。激活后,NK细胞经历mTORC1信号上调,增加葡萄糖摄取和有氧糖酵解,产生干扰素-γ(IFNγ)和颗粒酶B,发挥其效应器功能。它们的激活与ATP柠檬酸裂解酶(ACLY)表达的增加和柠檬酸进入胞浆的转运相一致,这可能与乙酰化和表观遗传控制有关。多项研究表明,外源性脂质可以破坏这种代谢程序,并对它们的效应器功能及其对刺激的反应能力产生负面影响,尤其是在肥胖的情况下。由于NK细胞吸收这些脂肪酸并将其储存在LDs中以防止脂肪毒性,FAO中参与的额外脂质转运蛋白和酶的表达也会增加,这可能会限制产生颗粒酶B和IFNγ所需的介导性糖酵解增加,从而导致NK效应器功能不足。这些发现对TME和富含脂肪细胞的微环境中的肿瘤进展具有重要意义。
在黑色素瘤,结肠直肠癌和乳腺癌模型中进行手术后,NK细胞的细胞毒性功能可能受损,从而导致复发和转移。手术治疗的结直肠癌患者NK细胞分为两个亚群,其中一个亚群显示脂质积聚增加,对应于CD36、CD68和MSR1脂质转运体的高表达。这些NK细胞显示出功能缺陷并且不能对癌细胞作出反应。这些研究表明,在进展过程中和治疗后,TME中NK细胞对脂质的摄取值得进一步研究。
中性粒细胞和髓源性抑制细胞
中性粒细胞被认为是人体中最丰富的免疫细胞,也可以募集到TME中,像巨噬细胞一样,它们可以起到免疫抑制或抗肿瘤作用。然而,它们的存在倾向于促进肿瘤的进展,并且似乎它们的代谢特征也参与其中。中性粒细胞主要利用糖酵解作用,很少有线粒体,并且对OXPHOS的依赖最小。但是,当葡萄糖供应不足时(例如在TME中),中性粒细胞可以利用FAO,从而支持ROS的产生并增加T细胞的抑制作用。这表明中性粒细胞从糖酵解转变为FAO可以通过免疫抑制促进肿瘤的发生,这在形态相似的多形核髓源性抑制细胞(PMN-MDSCs)中观察到。
PMN-MDSCs代表人类和小鼠中MDSC的大多数。它们的形态与嗜中性粒细胞类似,因此只能通过梯度离心或利用过表达凝集素型氧化LDL受体-1的方法将它们与嗜中性粒细胞分离。PMN-MDSCs在免疫抑制方面与单核细胞MDSCs相似,但其功能主要通过T细胞受体ROS依赖性硝化作用产生抗原特异性抑制。来自淋巴瘤、Lewis肺癌、结肠癌和胰腺癌的荷瘤小鼠的PMN-MDSCs通过脂肪酸转运体FATP2的高表达增加了脂质积聚。敲除FATP2导致PMN-MDSCs抑制CD8+T细胞的丢失,提示TME摄取脂肪酸参与PMN-MDSC肿瘤抑制。在PMN-MDSCs中通过其他脂肪酸转运体和结合蛋白如CD36和Lipocalin 2也有类似的发现。FAO可能通过ROS产生的过氧亚硝酸盐生成导致T细胞抑制,支持PMNMDSCs的免疫抑制。进一步了解脂肪酸在中性粒细胞向TME内MDSCs分化中的作用,以及允许这些代谢物促进MDSC免疫抑制的机制,将为TME中潜在的治疗靶标提供了一条新途径。
4. 影响治疗成功和复发的代谢因素
除靶向疗法(例如单克隆抗体,小分子抑制剂或免疫疗法)外,癌症疗法通常还采用化学疗法(CT),放射疗法(RT)和手术的组合。通常,CT和RT靶向快速分裂的细胞,但仍具有明显的正常组织毒性。RT可以用作癌症的姑息治疗或治愈性治疗,目前在所有癌症患者中有50%以上使用RT,通常每天分次使用。当与外科手术结合使用时,RT的目的是利用遗留在原发肿瘤部位的肿瘤细胞不良的DNA损伤反应机制。辐射损伤会导致直接的DNA损伤,双链断裂以及ROS的产生,这些ROS可能导致额外的DNA损伤或引起明显的氧化应激。CT可以用于新辅助手术,以减小手术前的肿瘤大小并杀死任何微转移灶,辅助手术后杀死残留的肿瘤细胞,以及在缓解后辅助杀死肿瘤以防止复发。通常,这些药物是非特异性的,可以影响细胞周期的各个阶段。这些化学治疗剂的很大一部分会引起遗传毒性,需要肿瘤细胞执行类似的修复机制才能幸免于DNA损伤。越来越多的FAO被认为是RT和CT耐药肿瘤细胞的标志。如前所述,线粒体外膜上的CPT1A是长链FAO的限速酶。线粒体内膜上的CPT2从酰基肉碱释放酰基辅酶A,开始进行β氧化过程,从而使乙酰辅酶A可用于三羧酸(TCA)循环中。人表皮生长因子受体2 (HER2)表达的抗辐射乳腺癌细胞和抗辐射乳腺癌干细胞的特点是CPT1A、CPT2高表达,FAO升高,高CPT1A、CPT2的患者预后差。抗辐射细胞通过增加FAO和ATP的生成来响应电离辐射。这导致ERK1/2的磷酸化增加,减少细胞凋亡,促进更有攻击性的表型。在鼻咽癌中,放射电离细胞在电离辐射后也表现出增加的FAO含量,其中CPT1A的过表达通过利用LD衍生的脂肪酸来增加FAO的含量来提高细胞存活率。与其他癌症相比,由于前列腺癌比有氧糖酵解更依赖于脂质β氧化和脂肪酸合成,因此与FASN抑制合用时,RT更为有效。在性腺脂肪组织中发现的急性髓系白血病细胞暴露于脂肪因子和脂肪酸,导致CD36表达、脂肪酸摄取和FAO增加,促进化学抵抗。很明显,为什么像Etomoxir这样的可阻断CPT1和FAO的药物被用作RT和CT敏化剂。这些研究表明,CT和RT耐药细胞在复发后如何响应治疗以提高生存率和促进侵袭性表型。关于这种存活机制的一个假说可能是由于谷胱甘肽的产生,这已经被证明可以增加乳腺癌中干细胞的放射抵抗力。β氧化增加可导致基于TCA的柠檬酸产生,可在细胞质中转化为乳酸或α-酮戊二酸,补充NADPH并最终促进谷胱甘肽的生成以清除ROS。
电离辐射和某些化学治疗剂(例如抗肿瘤抗生素)会产生ROS,这可能会导致DNA损伤,但也会破坏电子转运链,引起脂质过氧化,并抑制内质网(ER)中的适当蛋白质折叠。一些ER应激通常对细胞存活是积极的,但长期内质网应激可导致未折叠蛋白反应(UPR)。已显示电离辐射可直接导致多种正常和恶性细胞类型的ER应激。
化疗药物如紫杉烷类和抗代谢物已被观察到可诱导癌细胞ER应激,成功缓解这种应激可导致癌细胞的存货和对治疗的抵抗。其他研究表明,脂类合成和LD形成是解决ER应激所必需的,这表明辐射损伤,ER应激和脂质代谢之间存在潜在的联系。多项研究表明,UPR反应可以上调脂质合成,从而增加ER膜长度并产生增加的LDs,这有助于将错误折叠的蛋白质靶向ER相关的降解途径。毫无疑问,RT和CT之后的脂质合成,LD的形成和ER应激的消除是无疑相关的。这些研究表明,在RT或CT过程中靶向性脂肪酸的合成和LD的形成可以阻止ER应激的缓解,诱导细胞凋亡以提高疗效。
LPC-ATX-LPA脂质信号转导轴也与RT和CT后的癌细胞存活有关,特别是在乳腺癌中。大鼠腹部脂肪组织、人乳房和颈部脂肪组织的照射显示,脂肪组织的基质细胞在RT反应中分泌高水平的ATX。对大鼠肠上皮细胞辐射损伤的研究表明,通过LPAR2的LPA信号传导增强了DNA损伤的修复。同样,在体内对小鼠乳腺脂肪垫进行分次辐射后,血浆ATX浓度升高。该信号传导轴可能会促进治疗后癌细胞的存活,因为抑制ATX与体内分次RT的结合可导致Ki67阳性乳腺癌细胞减少以及凋亡标记物表达增加。此外,LPC-ATX-LPA信号轴可能会改善CT治疗后癌细胞的存活率。图3总结了治疗过程中调节肿瘤细胞存活的过程。
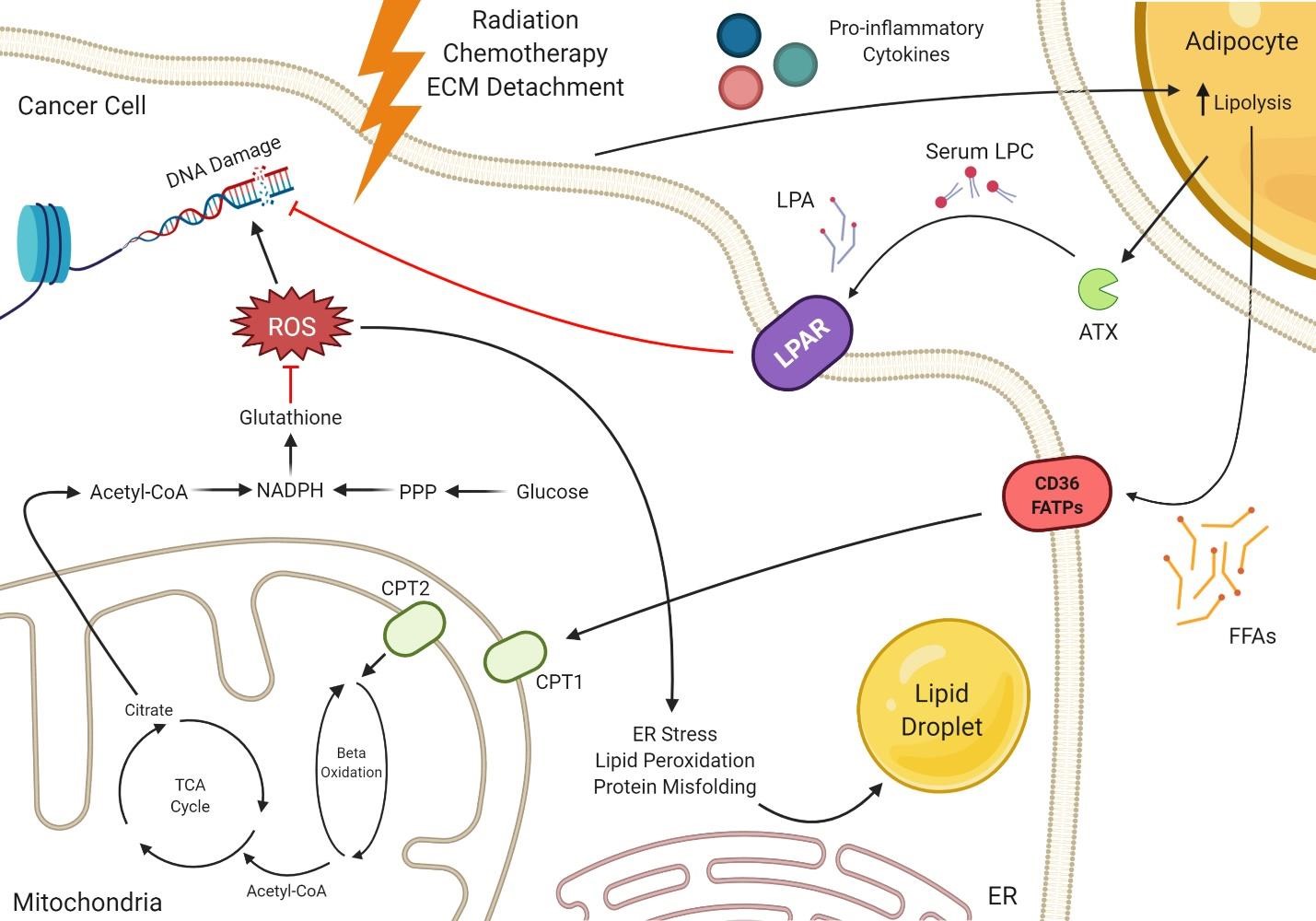
图3. 脂质代谢对治疗反应和转移的影响
5. 脂质及其在转移中的作用
对于癌细胞而言,转移定殖的过程是艰辛的旅程。肿瘤细胞必须从原发性肿瘤中脱离出来并进入血管,这是一种恶劣的环境,会杀死大多数循环中的肿瘤细胞(CTC)。最终,CTC可能会从循环中渗出,并在不同的组织中找到一个支持性的生态位,在那里它可能对大多数治疗产生抵抗并保持静止,直到因子促进其生长成为转移性病变。CTC细胞死亡可能与无法减少ROS和由于脱离ECM而导致的细胞应激有关。一些癌细胞通过与FAO相关的抗氧化剂生成增加而克服了这种ROS生成。有证据表明,淋巴结转移的侵袭性前沿显示FAO增加,并且可以通过etomoxir治疗减少淋巴结转移,这进一步支持了这一观点。但是,增加FAO的好处是糖酵解的中间体可以穿入PPP中,以控制细胞内ROS。在LDs内具有高水平从头脂肪酸合成和脂质积累的细胞可能具有适应性优势,因为它们储存了必要的燃料,以允许这种增加的氧化代谢。然而,细胞内ROS过多和过少之间的平衡可能需要细胞的转移,FAO可能参与ROS的产生,导致EMT和转移潜能相关的标记物增加。脂肪酸合成的减少和脂肪酸向线粒体的运输也显示出通过降低细胞内ROS水平降低转移的趋势。这减轻了DNA损伤,这种损伤通常会引起突变,使癌细胞能够在不同于其来源的组织部位定殖。
肿瘤细胞可能通过形成多细胞球体在循环中存活,而不饱和脂质水平的增加可能促进这些微生态位的形成。分泌的血管紧张素II与其受体的结合导致SCD1表达增加,支持以ER应激反应蛋白增加为特征的癌症球体的形成。细胞在这些分离的球体中生存很可能需要成功地解决ER应激,这可能是通过增加不饱和脂肪酸合成代谢而增加ER膜流动性来促进的。通过与基质微环境的相互作用可以改善定殖组织中的球体存活。肺成纤维细胞分泌组织蛋白酶B,该组织蛋白酶B通过与膜联蛋白A2结合并诱导PI3K / Akt / mTOR途径来诱导肿瘤细胞中SCD1的上调。在黑色素瘤、透明细胞肾细胞癌、胰腺腺癌和胸腺瘤患者中,这会增加转移性结节并降低无病生存率。在结肠癌中靶向SCD1可以减少向肺的转移,这种机制可能与乳腺癌向肺的转移有关。矛盾的是,这些支持转移的细胞簇可能以缺氧为特征,在这种情况下,通过SCD1脱饱和可能无效。在缺氧状态下,细胞可能不依赖于从头合成不饱和脂肪酸,而需要从环境中摄取这些脂肪酸。这可能是脂肪酸转运蛋白可用于减少转移的另一种机制。
这些研究表明,癌细胞利用脂质在循环中存活的方式可能存在显着的异质性。确切的机制可能与癌症的类型,原发性肿瘤的特定微环境或转移性级联反应是否发生在主要治疗之前或之后有关。依赖FAO或脂质去饱和途径可能与细胞是否形成球体、在球体内经历缺氧或参与单细胞输注有关。对引发转移级联反应的特定机制的更好理解将有助于阐明涉及脂质代谢的治疗方法,该方法可用于预防癌症扩散。这些机制的概述如图3所示。
6. 研究脂质和癌症的未来前景
最近的文献表明,有许多途径可以通过靶向TME中的脂质代谢和信号传导,改善对原发性癌性病变以及耐药和转移性细胞的治疗(图4)。了解脂质代谢如何影响RT和CT抵抗力,可能有助于设计针对癌细胞的脂质代谢重编程以改善治疗效果的药物。许多分析抗辐射性的研究使用单一的RT剂量,而不是跟临床相关的分级方案。探索分级RT可能会改变癌细胞利用脂质代谢发挥生存优势的方式。此外,这些研究通常评估单个细胞类型,并在进行体内研究之前采用2D细胞培养。通过分泌因子进行遗传毒性治疗后,包括肿瘤相关的基质细胞可能会影响癌细胞的存活。开发3D模型可能会提供更多生理相关的结果。

图4. 肿瘤微环境中脂质的几大主题
随着采用靶向脂肪酸合成和氧化的药物,评估癌细胞与相邻正常组织之间的代谢影响和串扰变得更加重要。我们已经表明,对正常组织的放射损伤可以募集CTC并促进复发。确定正常组织细胞如何将脂质代谢结合到其细胞存活机制中,可以提供对残留肿瘤细胞或募集的CTC的微环境的见解,从而可以进一步确定复发性疾病的靶标。最终,这些药物可能需要与靶向肿瘤的传递机制结合使用,以最大程度地降低全身传递的潜在脱靶效应。
随着世界范围内肥胖率的持续上升,有关微环境FFAs和脂肪因子增加的研究,无疑将继续被纳入涉及脂肪代谢和脂肪组织内或附近的癌症的研究中。新兴的研究已经开始评估代谢活化的常驻组织巨噬细胞,这些巨噬细胞可处理肥胖脂肪组织中垂死的肥大性脂肪细胞的高脂质负荷,这在表型上与M1 / M2分类均不同。这些细胞已经与三阴性乳腺癌的进展有关。了解这些驻留的组织免疫细胞如何影响癌细胞与基质环境(尤其是肥胖症)之间的脂质代谢串扰,应成为未来研究的重点。进一步阐明肥胖在癌症如何改变免疫反应中的作用,对于确定免疫细胞(如Tregs)如何在TME中比Teffs获得优势并最终导致免疫逃避也至关重要。了解以慢性炎症为特征的脂质信号传导和肥胖如何导致癌症预后较差应成为研究的重点领域。
显然,TME中的脂质可对癌症的进展,治疗,复发和转移产生巨大影响。这些无处不在的生物分子不仅在癌细胞的代谢和信号传导中起作用,而且还参与了肿瘤招募的免疫细胞和基质细胞的反应。继续揭示这些不同细胞类型之间的复杂相互作用,以及脂质如何改变彼此之间的反应,将为癌症患者开辟一条改进治疗和结果的道路。





