Nature Communications:与小鼠相比,人类雪旺细胞损伤后的脂质代谢适应性降低
周围神经虽然具有内在的再生潜力,但这种潜力因患者的年龄、损伤位置和严重程度而异。在啮齿动物中,周围神经的再生能力取决于雪旺细胞(SchwannCell,SC)的特性。损伤后,SCs通常从分化的髓鞘状态转变为再生修复表型。外周神经损伤(PNIs)后的急性期包括SC重编程、轴突变性和髓鞘碎片清除,被称为沃勒变性。随后,在损伤后的较晚阶段,随着轴突的再生和靶组织的重新支配,修复SCs重新分化为髓鞘SCs。
PNI中SC反应的一般特征在人类和啮齿动物中可能是保守的。然而,与PNI患者相比,啮齿动物的再生长和功能恢复更快。目前,解释物种间差异再生潜力的分子机制还很少。这主要是因为几乎没有关于活体内人SCs反应的数据,大多数可用的数据都是在SCs培养中产生的。
2020年5月,德国乌尔姆大学的相关研究人员在《Nature Communications》上发表了题为“与小鼠相比,人类雪旺细胞损伤后的脂质代谢适应性降低”的研究论文,对PNI后人和小鼠的神经组织进行了全面的比较,阐明了脂质代谢调节SC再编程的新机制。

研究人员首先建立了一个体外模型,用以对比人类和小鼠神经中的急性SC反应。与SC培养相比,该模型保留了3D结构和细胞-细胞接触。这种神经体外培养可进行尽可能接近患者体内环境的SC反应的研究。结果发现,相较于小鼠,人类神经中的轴突变性和髓鞘脱落似乎是延迟的(图1)。
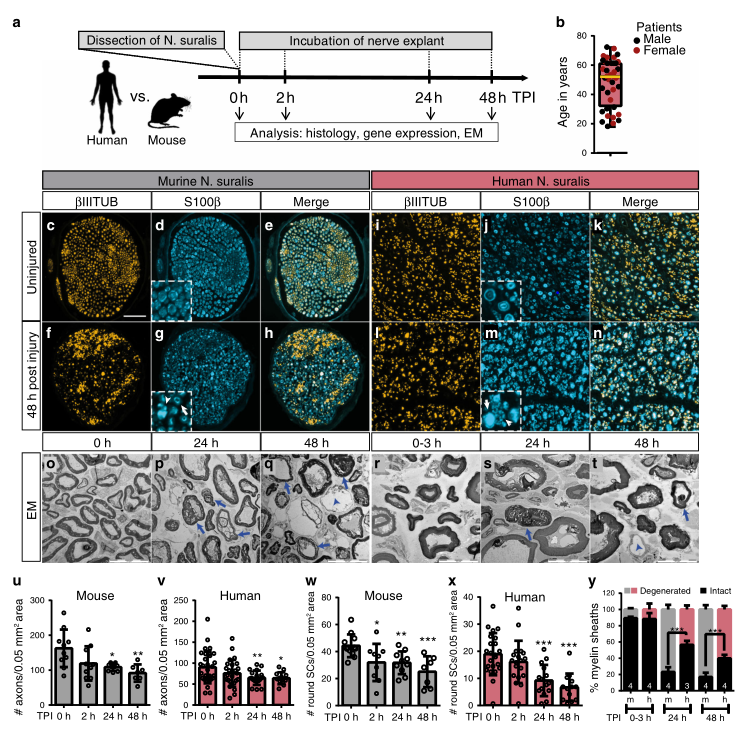
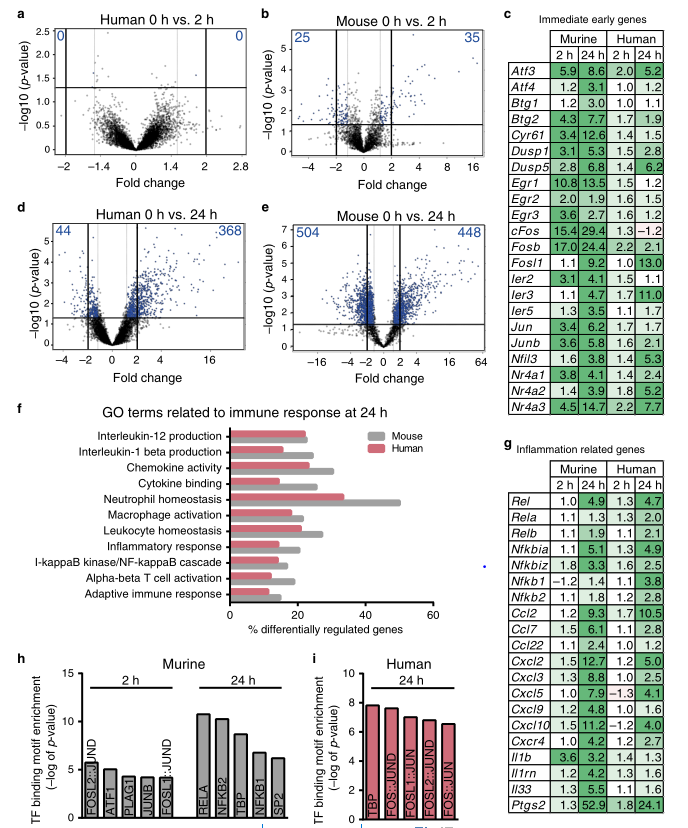
SCs体内再编程的一个关键事件是从分化到修复的基因表达切换,研究小鼠和人类神经中SC再编程的差异。结果发现,与人类SCs相比,小鼠SCs在选定的基因(ATF3,Shh)上表现出更明显的修复SC表型,而其他基因则遵循保守的表达谱(图2)。而对人与小鼠SCs的全基因组转录组学比较发现,人类和小鼠的神经具有共同的炎症基因反应,但在IEG(即刻早期基因,包括cos,jun等)诱导方面有所不同(图3)。
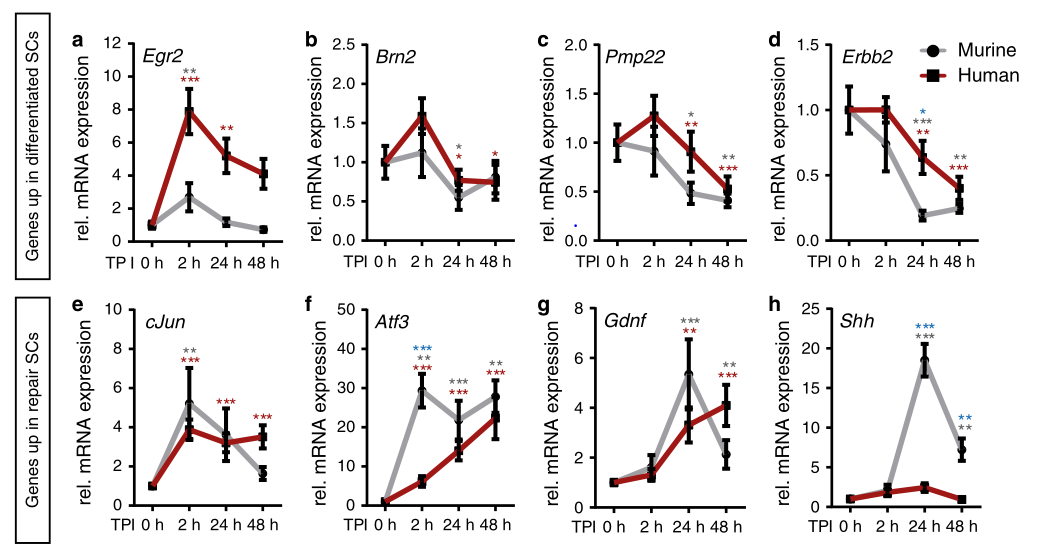
图2. 人和小鼠雪旺细胞(SCs)损伤后基因表达谱的变化
损伤诱导的小鼠SCs的一个显著变化是代谢适应,这影响糖酵解、柠檬酸循环和最明显的脂质代谢。许多与脂质代谢相关的基因组数据在小鼠中发生了改变,但在人类神经中基本上不存在这种情况(图4)。为了解释脂质基因调控对血脂水平的直接影响,研究人员随后进行了脂质组学研究。数据表明,鞘脂信号可能是调节受损小鼠急性反应的关键成分,但在人类神经中不是那么重要(图5)。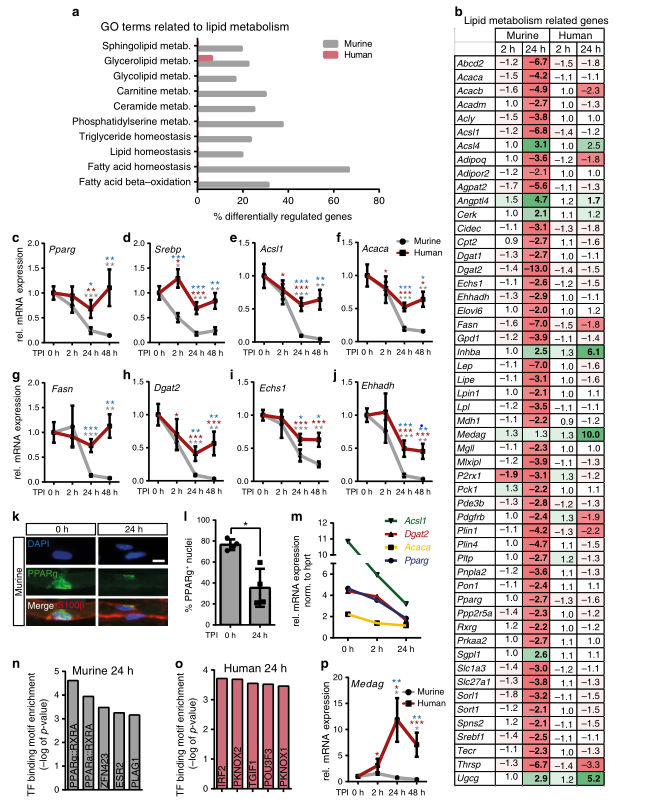
图4. 脂质代谢在损伤小鼠而非人的神经脂中下调
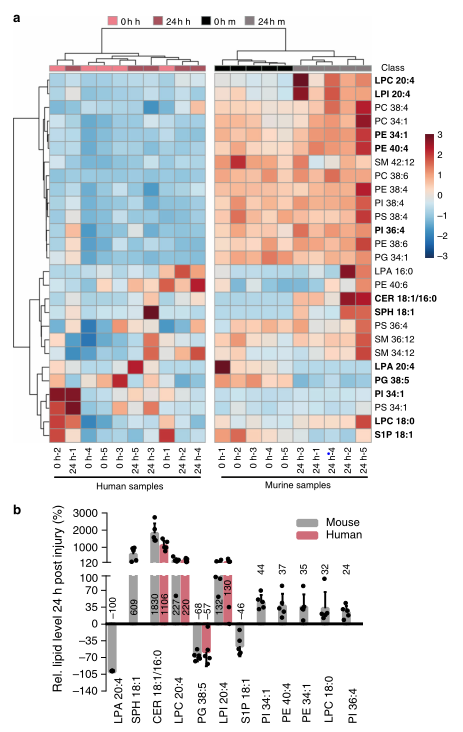
以前的研究表明,S1P与PPARg相互作用可以上调成脂基因。此外,药理学上的PPARg激活挽救了SCs的发育性髓鞘形成缺陷。接下来,研究人员探究了S1P水平和PPARg活性的变化是否影响受损神经中成脂基因的表达,以及PPARg在PNI相关基因表达中的作用。结果发现,PPARg激活通过有利于SC保持在分化状态而不是进入修复状态来干扰SC的重新编程。因此,PPARg可能在髓鞘形成和修复SCs之间的转换中起重要作用。
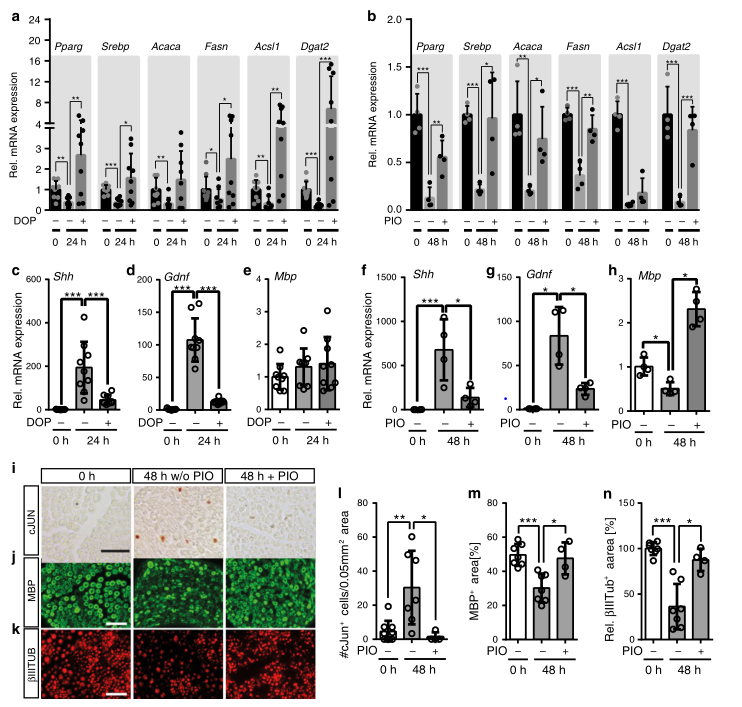
最后,研究人员探究了人类SCs对药理学PPARg调节的反应,研究人员用抗糖尿病药物PIO测试对人类SCs的影响,发现PIO增加了人类神经样本中PPARg、ACACA、FASN和DGAT2等基因的表达,而药理学的PPARg激活甚至导致了比未损伤的神经更高的mRNA丰度,这可能是由于损伤后PPARg的有限下调所致(图7)。
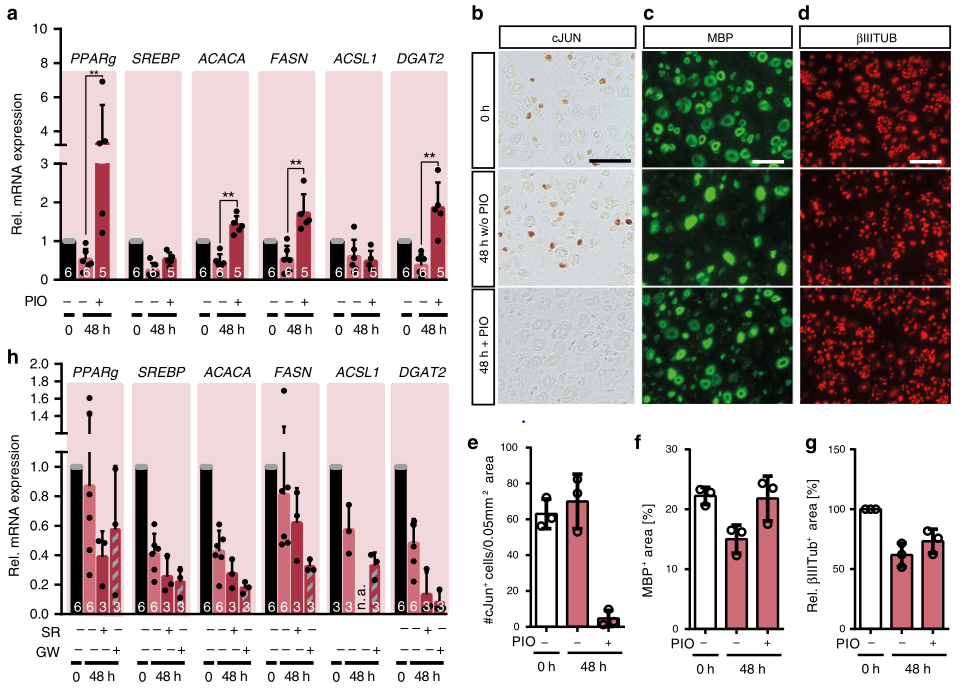
总体而言,PPARg在调节小鼠和人类神经中与脂肪酸代谢有关的酶的基因表达方面发挥着作用,其在损伤后的下调似乎对于SC重新编程期间的脂质代谢的适应是重要的(图8)。
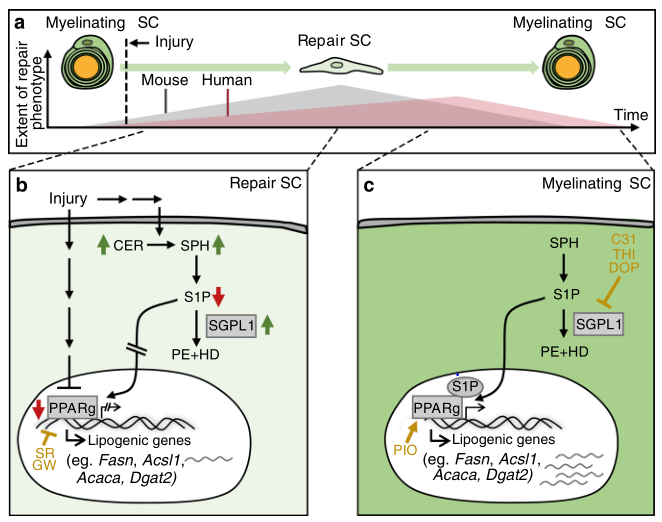
综上所述,该研究结果确认了脂质代谢的调节是从根本上影响SC再编程的一条新途径,并提示这可能是PNI患者药物治疗的一个有前途的靶点。
常州中科脂典生物技术有限责任公司
Bridging Metabolome and Health
地址:常州市新北区梅山路3号科技转化楼6楼北
电话:0519-82018180
邮编:213125
邮箱:sales@lipidall.com
服务热线: 0519-82018180
微 信 公 众 号
微 信 客 服 号
©2018 常州中科脂典生物技术有限责任公司 苏ICP备17014106号






