Journal of Hepatology:靶向脂质组学揭示急性失代偿性肝硬化患者循环脂质介体的广泛变化
急性失代偿性(AD)肝硬化患者常死于多器官衰竭,这是一种慢加急性肝衰竭(ACLF)的急性综合征。ACLF与反复感染和高短期死亡率密切相关, ACLF中的全身炎症和组织/器官损伤是由细胞因子/趋化因子和氨基酸衍生因子(作为代谢毒素)的协同作用触发的。
大多数生物活性脂质介质是由膜磷脂经磷脂酶A 2作用释放的多不饱和脂肪酸(PUFAs)在细胞内产生的。脂质介质是一种信号分子,对血液和组织的稳态以及对应激和损伤的反应具有强大而多样的作用。然而,脂质介质种类在ACLF全身炎症发病机制和器官衰竭发展中的作用目前尚不清楚。
2020年4月,欧洲慢性肝衰竭研究基金会、西班牙巴塞罗那大学临床医院、瑞典卡罗林斯卡学院等单位的相关研究人员在《Journal of Hepatology》上发表了题为“靶向脂质组学揭示了急性失代偿性肝硬化患者循环脂质介体的广泛变化”的研究论文,揭示了与AD肝硬化患者的严重程度和预后相关的特定脂质介质。

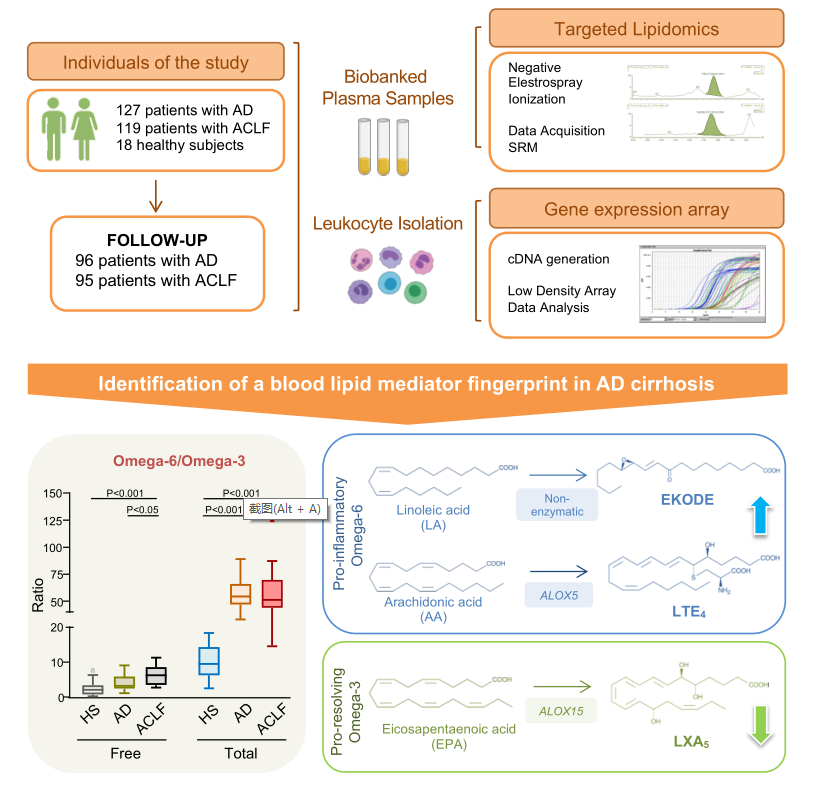
研究人员通过LC-MS / MS技术评估AD肝硬化患者、有(119)和无(127)ACLF患者以及健康受试者(HS,n=18)血浆中脂质介质的分布。对191例AD肝硬化患者在28天随访期间进行前瞻性重复测量,最终数据库包括总共59种脂质介体。结果发现AD患者和ACLF患者血浆中AA水平、AA/EPA比值升高,此外,除了分别上调和下调的SCD1和ELOVL6外,肝硬化患者白细胞中与脂肪酸去饱和与延长相关的基因没有显著改变(图1)。
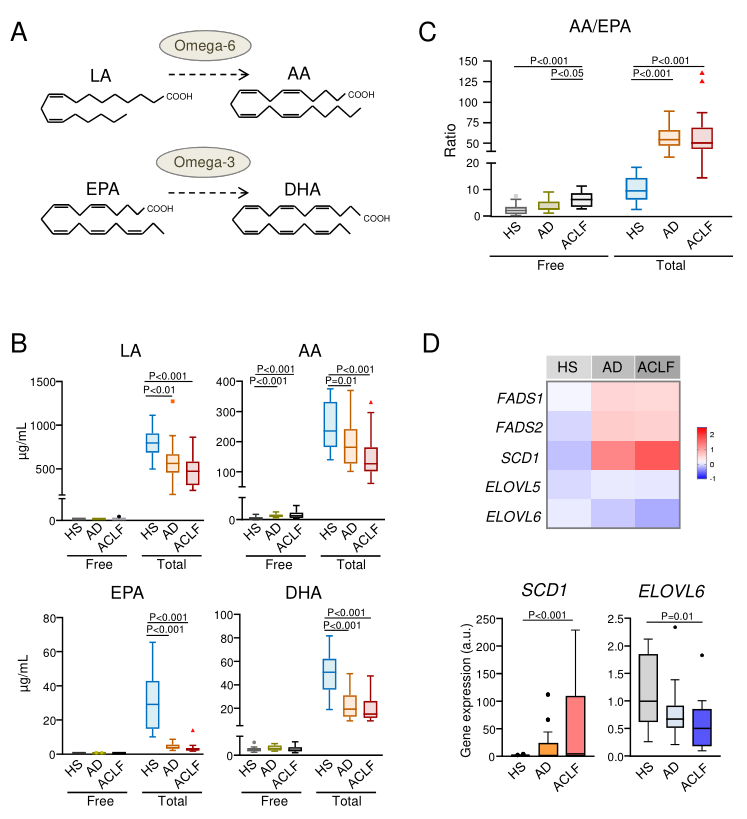
图1. AD肝硬化患者的 ω-6/ ω-3比例失衡
从多不饱和脂肪酸生物合成脂质介质涉及一个由LOX、COX和CYP450酶组成的复杂网络。脂质介质血浆丰度显示,AD和ACLF患者脂质介体的血浆分布不同,此外,研究人员还发现,患者和HS之间脂质介体生成酶的白细胞基因表达不同(图2)。
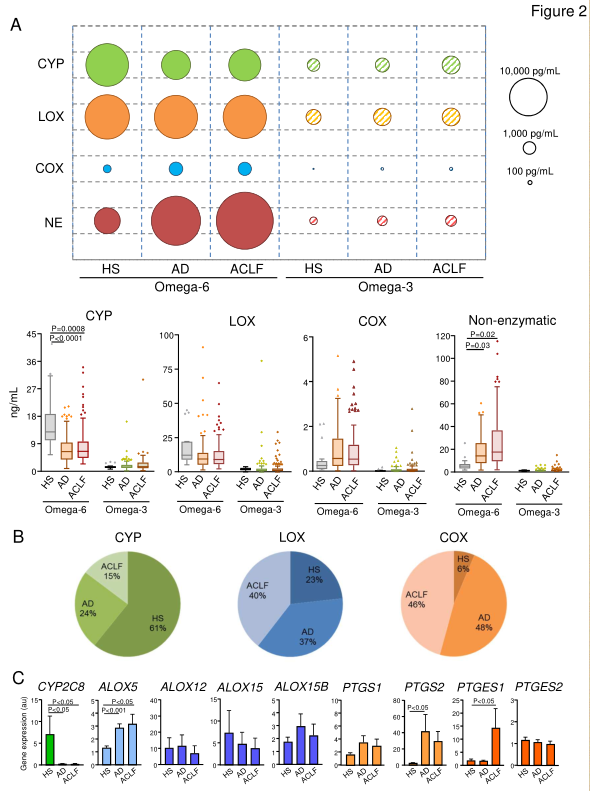
图2. AD肝硬化患者白细胞脂质介体的生物合成改变
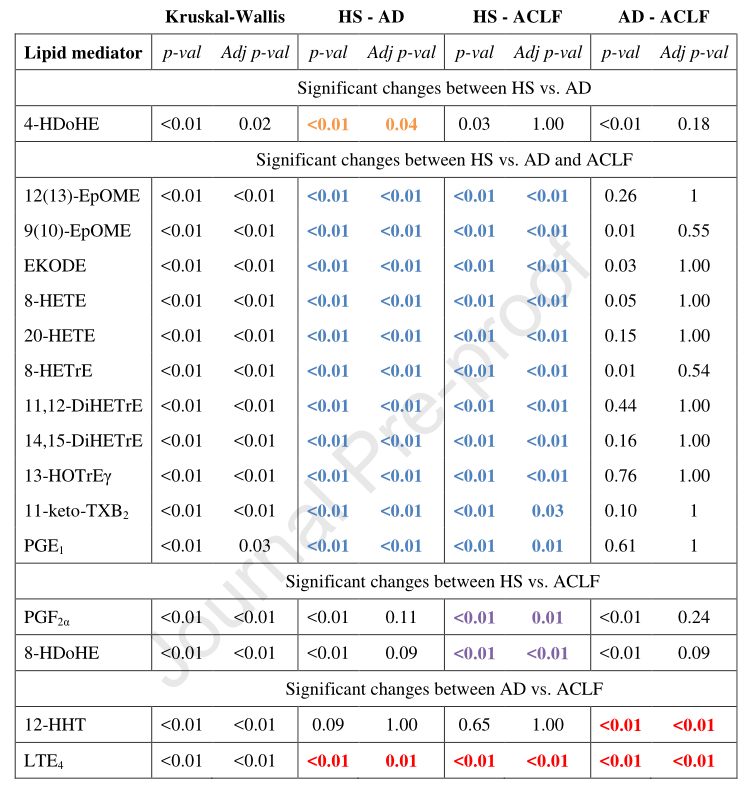
接下来,研究人员将患者血浆中检测到的59种脂质介质按其同源化学家族进行分组,并计算每个家族在AD vs HS和ACLF vs HS中的折叠变化。发现AD患者和ACLF患者相对于HS的脂质介体表现出不同特征(图3)。在对整个研究队列中基线时收集的59种脂质介质进行了无偏主成分分析后,经过性别和年龄的调整,研究人员将分离疾病不同阶段的脂质介质的数量从59个提高到16个(图3)。值得注意的是,在这16种脂质介质中,DHA产物4-HDoHE能将AD患者与HS区分开来,而11种脂质介质能将HS与任何阶段(AD或ACLF)的患者区分开来,两种脂质介质(PGF 2α和8-HDoHE)能将ACLF患者与HS患者区分开来,重要的是,来自AA的LTE 4和12-HHT形成了一个最小的血浆指纹,可以区分ACLF患者和AD患者(表1)。
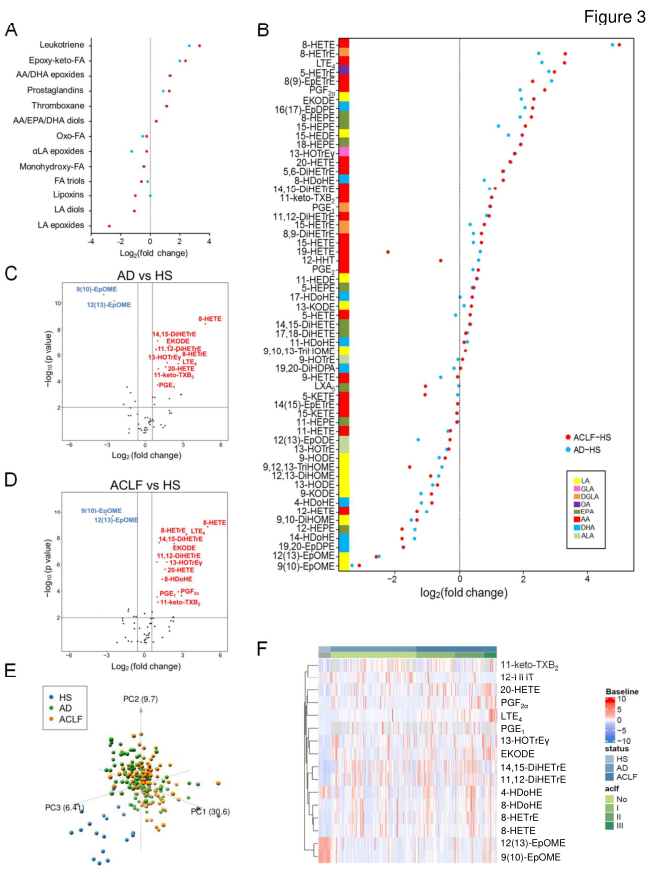
图3. AD肝硬化脂质介质特征的鉴定
表1. 脂质介体与患者病情进展的关联分析
进一步研究发现,LTE 4似乎具有强大的鉴别能力,可区分ACLF 3级与ACLF 1级和2级,并随疾病的临床进程而变化(随病情恶化而升高,随病情好转而降低)(图4),此外,它还与炎症和非凋亡细胞死亡标志物呈正相关(图5)。
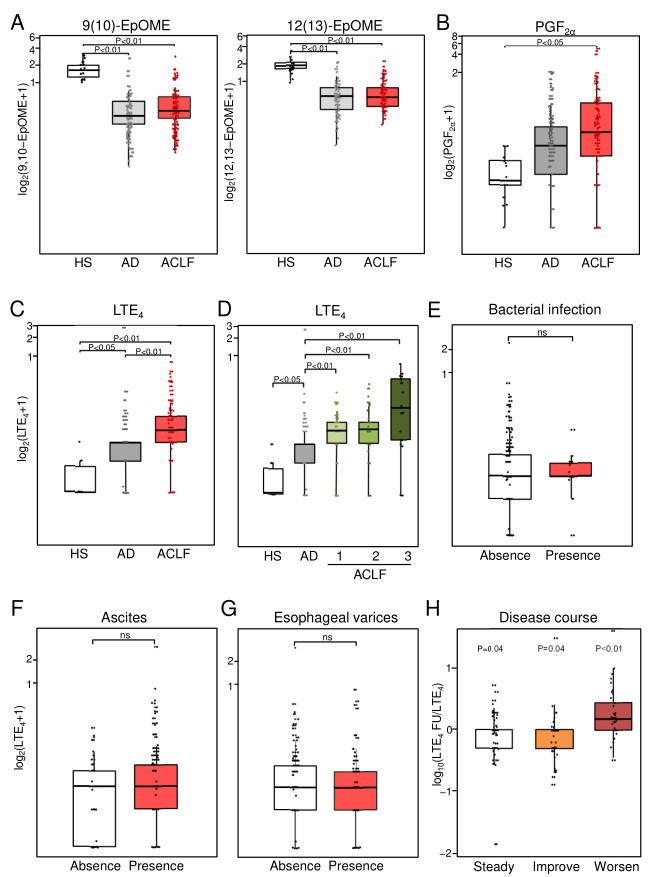
图4. LTE 4区分疾病严重程度
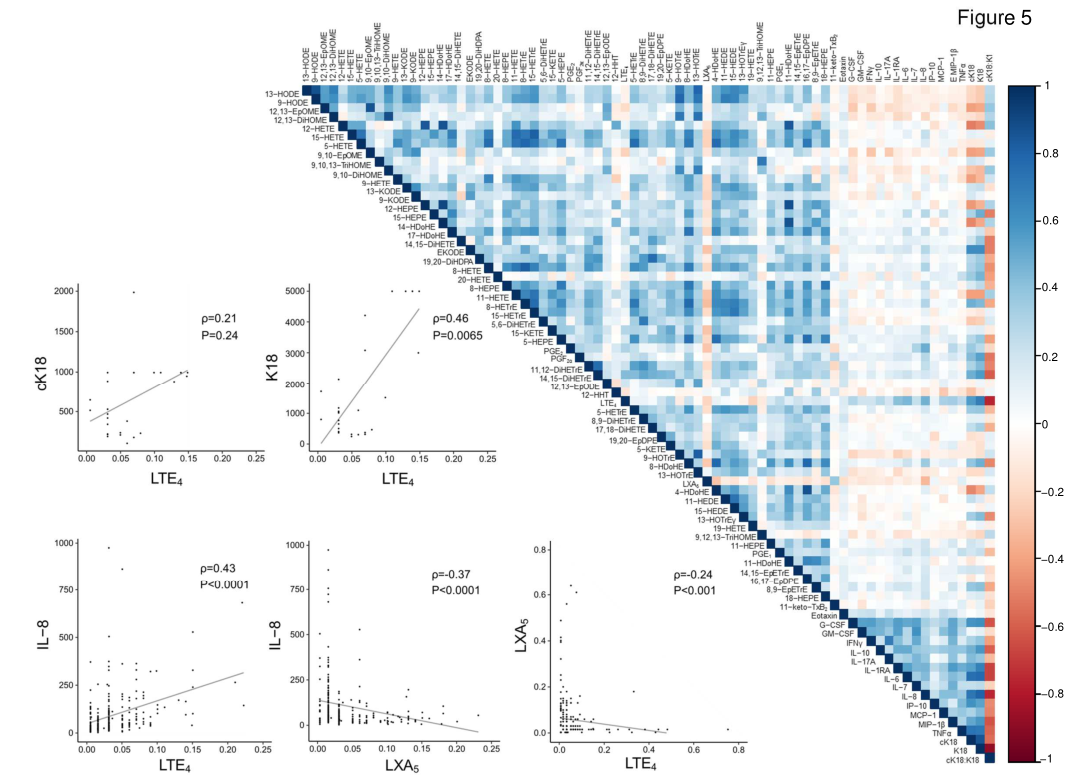
图5. 脂质介质与炎症和细胞死亡标志物的关联
最后,研究人员探究了在基线时收集的59种脂质介质与AD和ACLF患者最常见的器官衰竭(即循环系统、大脑、凝血、肝、肾和呼吸系统)之间的关系。结果发现,LTE 4、LXA 5和EKODE与短期死亡率相关,而LXA 5和EKODE形成了与凝血和肝衰竭相关的特征性轮廓(图6)。
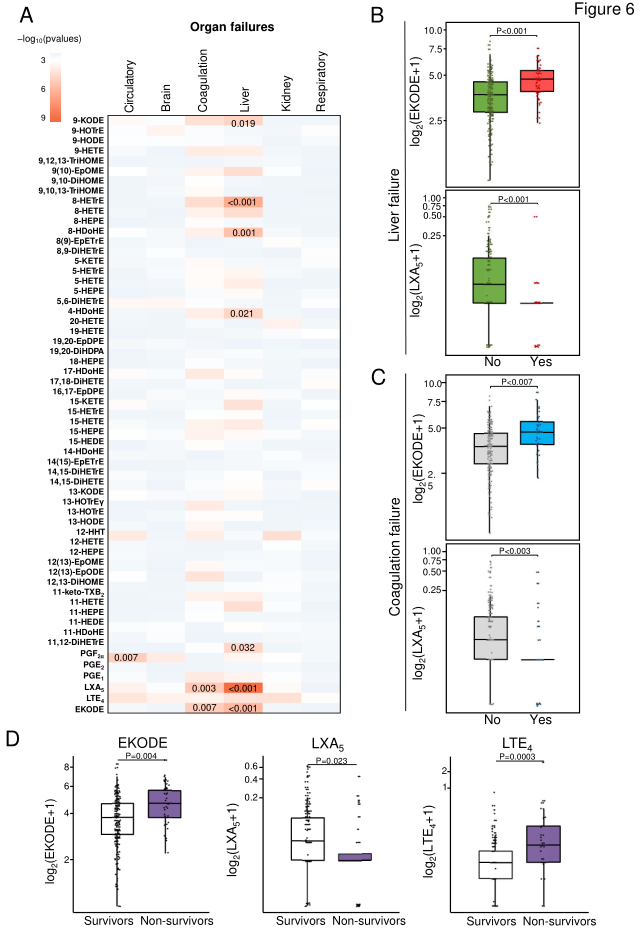
图6. 脂质介体与器官衰竭和短期死亡率的关联
综上所述,该研究提供了一个明确的临床定义队列(即典型队列)中有和没有ACLF的AD肝硬化患者血浆中100种PUFA衍生脂质介质水平的综合分析。确定了在任何阶段(AD或ACLF)将健康与肝硬化患者区分开来的11种脂质介质,2种脂质介质(LTE 4和12-HHT)可将ACLF患者与AD患者区分开来,另外2种脂质介质(LXA 5和EKODE)可形成肝脏和凝血功能衰竭的最小血浆指纹。此外,LTE 4可区分ACLF 3级与ACLF 1级和2级,其血浆水平随疾病的临床进程而变化,与LXA 5和EKODE一起与短期死亡率相关。该研究为AD肝硬化患者的全身炎症和器官衰竭的发生和发展提供了有益的见解。