CIR: 李咏生团队揭示RIPK3调控肿瘤相关巨噬细胞脂肪酸代谢与肝癌发生
肿瘤相关巨噬细胞(TAMs)与肿瘤发生发展密切相关。TAMs按表型不同分为M1型和M2型:M1型发挥抑制肿瘤生长的作用,而M2型则促进肿瘤生长、血管新生和肿瘤转移。因而诱导TAMs从M2表型分化为M1表型,阻断M2型TAMs的促肿瘤效应,将为抗肿瘤治疗提供新思路。然而在肿瘤微环境中TAMs如何被改造为M2型以及如何逆转M2型TAMs向M1型极化尚不清楚。现今越来越多的证据表明巨噬细胞极化过程与其代谢重编程密切相关, M2型巨噬细胞的存活及活化则主要依赖于脂肪酸的氧化即氧化磷酸化(OXPHOS)提供能量。
2020年3月,陆军军医大学新桥医院临床医学研究中心、中国科学院遗传与发育生物学研究所的相关研究人员在《Cancer Immunology Research》(2018年度影响因子8.62)上发表了题为“RIPK3通过调控肿瘤相关巨噬细胞脂肪酸代谢抑制肝癌发生”的研究论文,阐述了RIPK3对肿瘤相关巨噬细胞脂肪酸代谢调控和肝癌发生的影响及其相关机制。临床医学研究中心博士后吴磊,博士生张潇,肝胆外科郑璐教授为本文共同第一作者,李咏生教授为本文通讯作者。

研究人员在二乙基亚硝胺(DEN)联合胆碱缺乏氨基酸(CDAA)饮食诱导的小鼠肝癌模型中,比较了肿瘤相关巨噬细胞和库普弗细胞中受体相互作用蛋白激酶3 (RIPK3)的表达水平;体内实验比较WT和RIPK3 KO的小鼠肝癌组织体积、肝功能、TAMs脂肪酸代谢、功能表型。研究发现,小鼠肝癌模型中的TAMs中RIPK3的表达显著下调,且呈M2型极化,RIPK3 KO的小鼠肝癌明显加重,肝组织损伤更重,TAMs浸润显著增加,且TAMs的M2型标志物CD206和Arg1显著上调(图1)。

图1. 小鼠肝癌模型TAM与Kupffer细胞中RIPK3表达降低,RIPK3敲除会加重小鼠肝癌程度,促进TAMs向M2型极化。
作者检测了WT和RIPK3 KO组TAMs中脂肪酸合成(FAS)和脂肪酸氧化(FAO)情况,发现:RIPK3 KO的TAMs胞内脂滴积聚更多,FAS相关基因FASN、ACC、SCD1、DGAT1,FAO相关基因ACADVL、CPT1A、CPT1B以及脂解相关基因LIPE、LPL、ABHD5等均显著上调;代谢流检测实验亦证实RIPK3 KO组FAO能力增强,表明RIPK3可以调控巨噬细胞脂代谢(图2)。
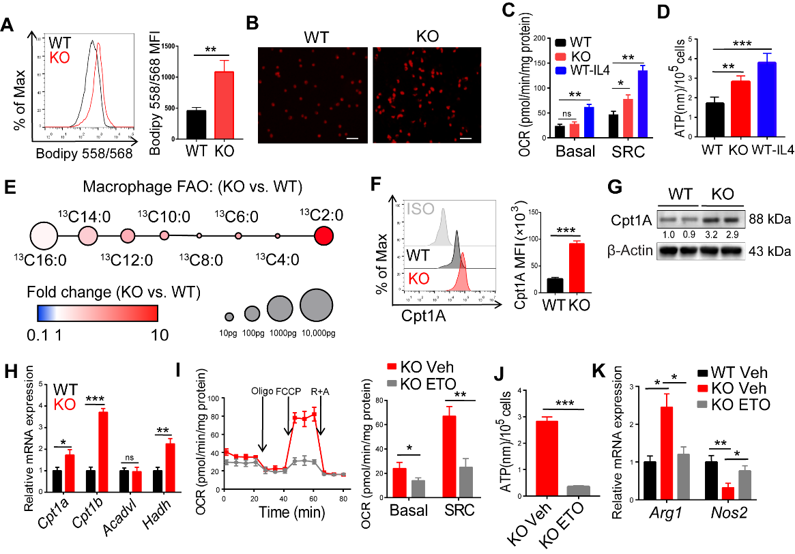
图2. RIPK3敲除小鼠TAMs脂肪酸氧化及脂肪酸合成能力上调。
为了确定RIPK3通过何种途径调控TAMs脂肪酸代谢,研究人员测定了WT和RIPK3敲除小鼠TAMs中活性氧(reactive osygen species, ROS)的表达,发现RIPK3敲除TAMs后ROS表达显著下调,而PPAR通路PPARα、PPARγ及其下游基因Cpt1a表达显著上调,同时RIPK3敲除TAMs中caspase1表达显著下调,表明RIPK3通过上调ROS激活caspase-1切割PPARγ而抑制TAMs脂肪酸氧化使得巨噬细胞向M1型极化(图3)。
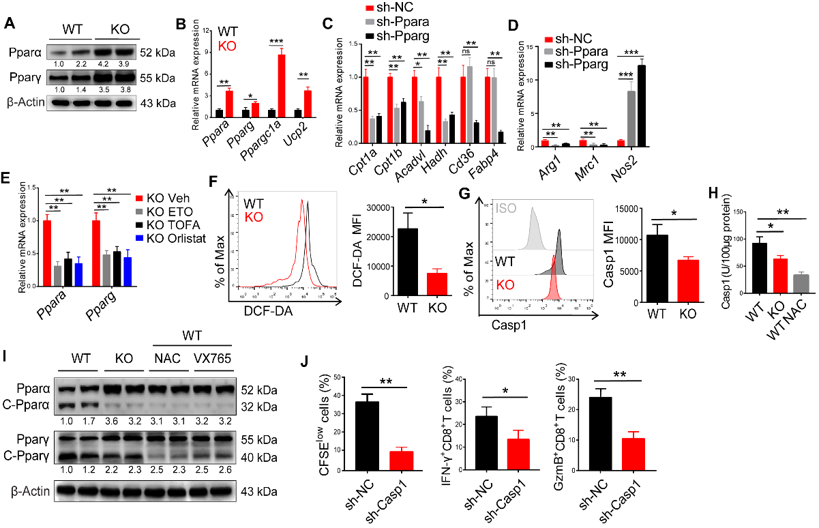
图3. RIPK3通过上调ROS-caspase1-PPAR通路抑制TAMs脂肪酸氧化。
最后,研究人员发现使用脂肪酸氧化抑制剂乙莫克舍(ETO)、脂肪酸合成抑制剂TOFA和脂解抑制剂Orlistat处理则均能抑制TAMs FAO水平,并抑制RIPK3敲除TAMs向M2型极化。进一步体内实验证实,使用脂肪酸氧化抑制剂ETO,或使用抑制剂GW9662干预PPAR信号通路可抑制TAMs FAO所致的M2型极化和肝癌发生(图4)。

图4. 抑制TAMs脂肪酸氧化逆转TAMs向M2型极化和肝癌发生。
综上所述,该研究表明RIPK3通过caspase1-PPAR信号通路抑制TAMs脂代谢促进M1型极化从而抑制肝癌发生(图5)。该研究揭示了程序性坏死核心分子RIPK3编程巨噬细胞脂代谢在肿瘤免疫中的作用机制,为临床抗肝癌的免疫代谢治疗策略的开发提供了新思路。
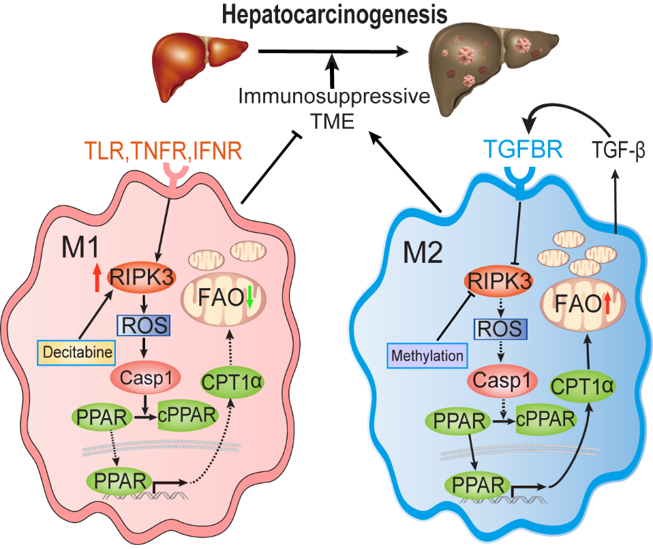
图5、RIPK3调控TAMs脂代谢介导肝癌发生的机制图





