Nat. Commun.:鸟类飞行退化的机制与能量代谢密切相关

2019年6月,中国科学院动物研究所、北京师范大学、北京生命科学研究所、中国科学院大学、中国科学院遗传与发育生物学研究所的相关研究人员在《Nature
Communications》杂志上发表了题为“鸟类飞行退化的趋同基因组特征表明了其主要能量的转变”的研究论文。
鸟类的飞行退化和飞行本身一样是鸟类与众不同的特征之一。虽然形态学和生理学上的差异在飞行退化鸟类中得到了确认,但它们对现代鸟类反复出现的飞行退化事件的作用以及潜在的遗传机制仍不清楚。研究人员在对48个鸟种(8种飞行退化鸟种和40种飞行鸟种)基因组的2.95亿个核苷酸的分析中,确定了两个在飞行退化的鸟类中导致ATGL Ser321Gly和ACOT7 Ala197Val氨基酸变化的趋同位点,而这两个位点之前被认为与飞行退化并无关联。这两个位点分别落在两个脂质代谢关键酶的核心结构域(ATGL, Adipose triglyceride lipase; ACOT7, Acyl-CoA Thioesterase 7):ATGL通过水解甘油三酯促进脂肪用于能量代谢,而ACOT7通过水解脂酰辅酶A(Acyl-CoA)抑制脂肪用于能量代谢。功能实验表明,Ser321Gly降低了ATGL的脂质水解能力,Ala197Val提高了ACOT7的酰基辅酶A的水解活性。建模仿真表明,在飞行退化的鸟类中,主要的能量来源从脂类转变为碳水化合物。因此,该研究结果表明,生理趋同在飞行退化过程中起着重要作用,改变了“鸟类飞行能力退化主要是形态结构变异特别是翅长变短所导致的”这一流行观点。
图1. 飞行退化鸟类趋同进化位点的识别
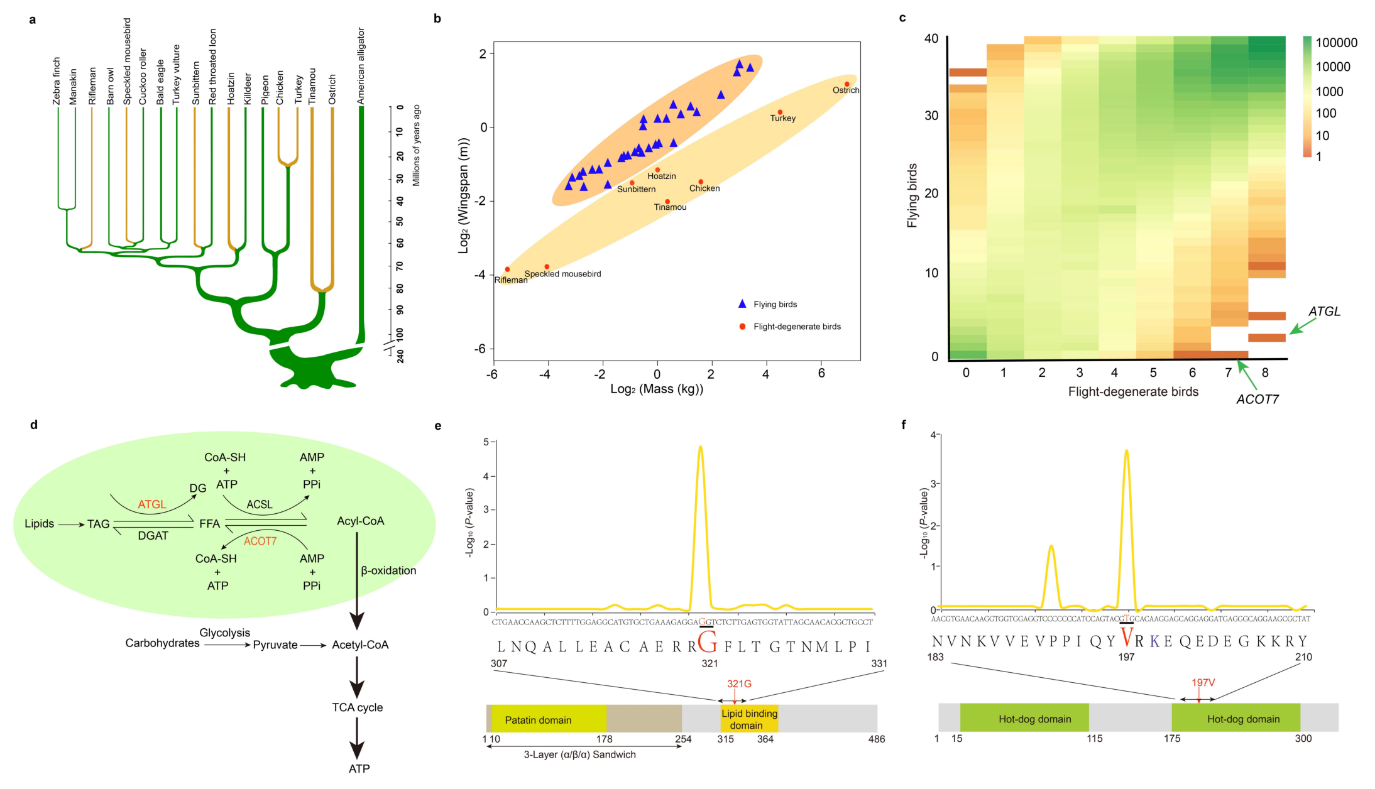
(a):以美洲短吻鳄为外缘的系统发育树,显示了八种飞行退化鸟种的趋同性。
(b):对飞行和飞行退化物种进行了分类。将每种动物的平均体重与其平均翼展测量值进行对比。
(c):飞行和飞行退化物种核苷酸的二维频谱。
(d):ATGL和ACOT7参与的途径。
(e)、(f):脂质代谢的主要途径被附上阴影,上面显示了ATGL(e)和ACOT7(f)上代表性核苷酸的有效值,中间显示了氨基酸序列,底部显示了示意图区域。已识别的趋同位点以红色突出显示。
图2. 取代ATGL ATG321GGT的功能验证

(a):3.7%甲醛固定后,ORO染色的人Hela细胞的图像。
(b):比较野生型和突变型(n=90)的脂滴数。
(c):比较野生型和突变型(n=90)的脂滴面积
图3. 取代ACOT7 GCG197GTG的功能验证
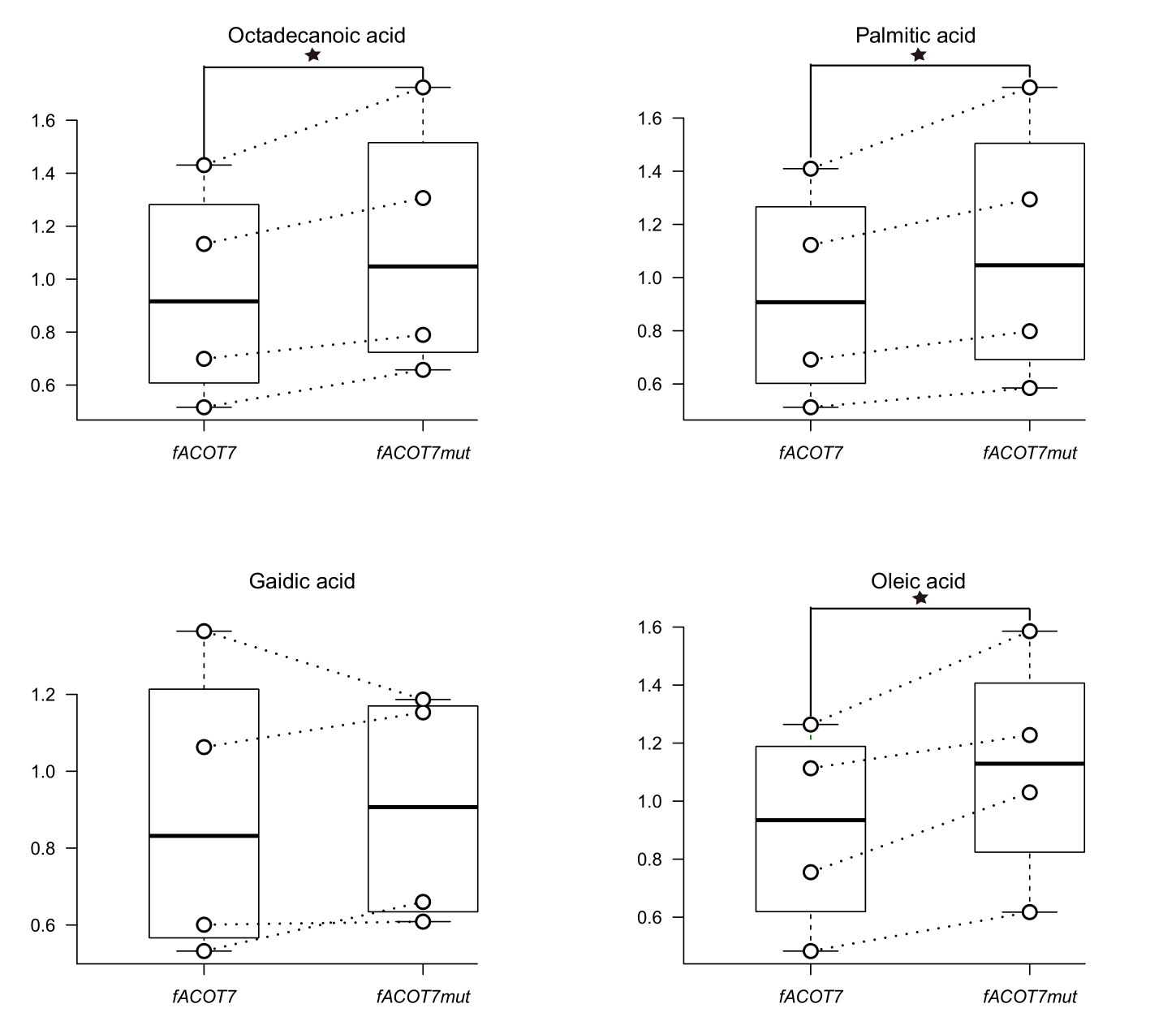
用气相色谱-质谱法测定了ACOT7野生型和ACOT7突变型小鼠脂肪细胞中游离脂肪酸的丰度。对于每种游离脂肪酸,野生型和突变型之间的丰度进行比较,中间值、第一和第三个四分位数显示在方框中(中间条代表中间值、上界代表第三个四分位数、下界代表第一个四分位数)。
图4. 模拟功能变化对能量结构的影响
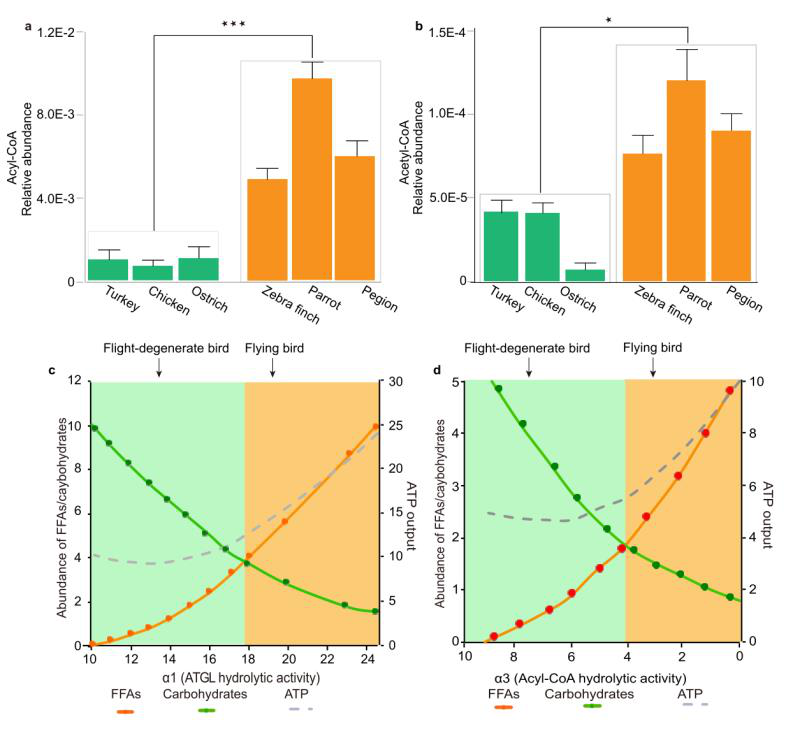
用液相色谱-质谱法测定了三种飞行退化品种(火鸡、鸡和鸵鸟)和三种飞行品种(斑马雀、鹦鹉和鸽子)的酰基辅酶A(a)和乙酰辅酶A(b)的实际丰度,ATGL和ACOT7的模拟结果分别见(c)和(d)。
图5. 飞行和飞行退化鸟类的窝产卵数的比较

x轴表示窝产卵数大小,y轴表示鸟类种类的比例。颜色表示分布的累积尾部概率。
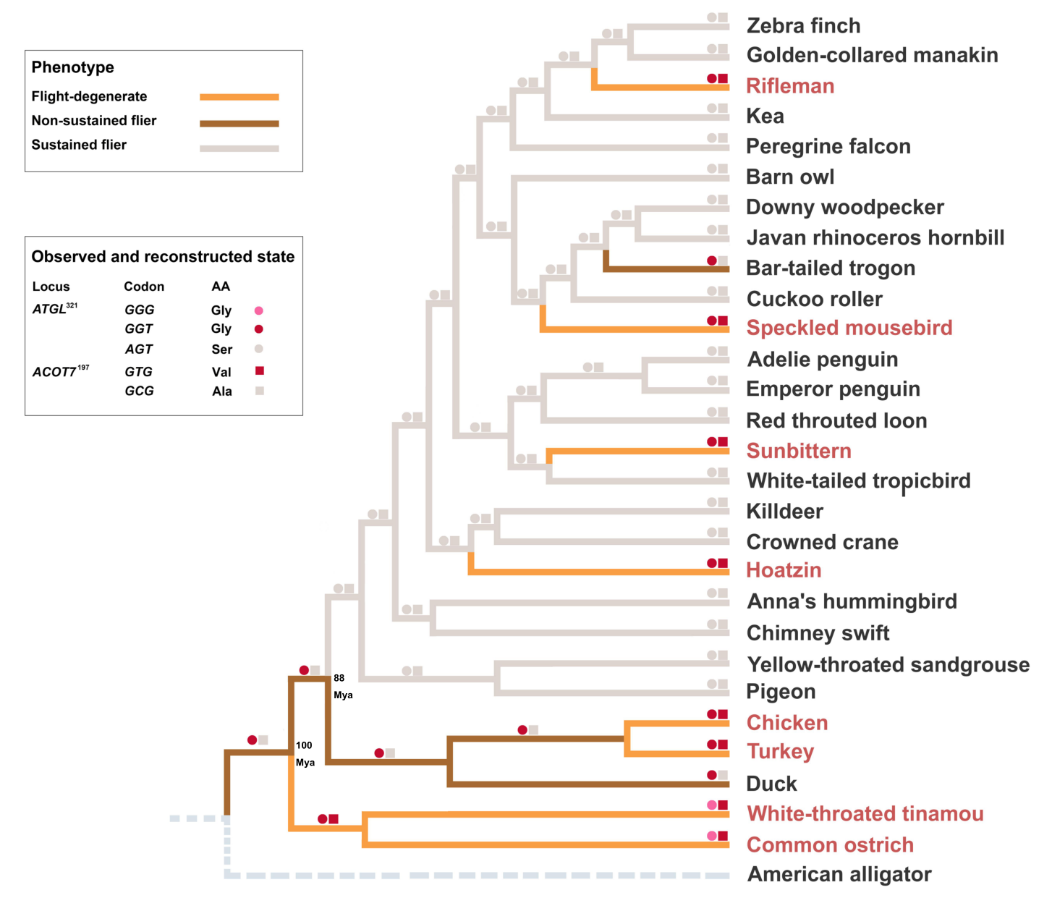
图6. TGL321和ACOT7197密码子的祖先位点重建
常州中科脂典生物技术有限责任公司
Bridging Metabolome and Health
地址:常州市新北区梅山路3号科技转化楼6楼北
电话:0519-82018180
邮编:213125
邮箱:sales@lipidall.com
服务热线: 0519-82018180
微 信 公 众 号
微 信 客 服 号
©2018 常州中科脂典生物技术有限责任公司 苏ICP备17014106号






