Nature Communications: 多模型+多组学精准锁定胰腺导管腺癌化疗新靶点
靶向ELOVL6以破坏胰腺癌中c-MYC驱动的脂质代谢,从而增强化疗敏感性
2025年2月,西班牙Francisco de Vitoria 大学等单位的研究人员在《nature communications》(IF: 14.7)上发表了题为“Targeting ELOVL6 to disrupt c-MYC driven lipid metabolism in pancreatic cancer enhances chemosensitivity”的研究论文,揭示了脂质合成在胰腺导管腺癌(PDAC)进展中的作用,为癌症治疗开辟了新领域。

-
c-MYC在肿瘤进展过程中直接上调ELOVL6的表达。 -
对 ELOVL6 进行基因或化学抑制,可通过改变脂肪酸组成,影响细胞膜的刚性、通透性和胞饮作用,从而降低肿瘤细胞的增殖和迁移能力。 -
ELOVL6会增加肿瘤细胞对Abraxane的摄取,ELOVL6 有望成为改善胰腺导管腺癌治疗效果的靶点。
研究背景:
胰腺导管腺癌(PDAC)是一种致死率极高的疾病,其生存率仅为12%。迫切需要深入了解PDAC的分子机制,以便开发出更有效的治疗方案。肿瘤细胞会进行膜重组,以促进增殖、逃避凋亡,并阻碍化疗药物进入。脂质在细胞功能中起着至关重要的作用,它有助于维持能量平衡,并通过形成细胞膜来保持细胞的完整性。抑制脂肪生成在癌症治疗中已显示出显著益处,一些抑制剂已进入临床前研究阶段。然而,在PDAC中的潜力仍需进一步研究。
c-MYC癌基因是一种转录因子,与三分之一的人类疾病相关,在癌症中起着关键作用,影响基因转录、蛋白质翻译、细胞周期和代谢等过程。值得注意的是,c-MYC在PDAC中至关重要,42%的病例中存在c-MYC过表达,但由于它参与众多细胞过程,直接靶向c-MYC颇具挑战;因此,确定其下游效应分子势在必行。
在c-Myc依赖性胰腺癌小鼠模型(Ela1-Myc小鼠)中,c-Myc受弹性蛋白酶(Ela1)启动子的控制,使c-Myc在腺泡区过表达。利用8周龄Ela1-Myc小鼠胰腺的RNA测序(RNA-seq)数据,研究人员进行了基因集富集分析(GSEA)和全面的转录组分析,发现在Ela1-Myc小鼠中,与E2F靶点、细胞周期、DNA复制以及Myc靶点相关的基因上调;与增殖和致癌信号相关通路的显著富集。为研究c-Myc在脂质代谢中的作用,研究人员分析了c-Myc靶基因,发现与野生型小鼠相比,Ela1-Myc小鼠的Fasn、Scd1、Acly、Acaca以及多种Elovls基因均呈现过表达。Ela1-Myc模型的染色质免疫沉淀测序(ChIP-seq)数据显示,c-Myc结合在Elovl1和Elovl6的启动子区域。研究人员利用KPC小鼠模型(在该模型中致癌性 Kras 和突变型 p53 在胰腺祖细胞中表达)的ChIP-seq数据以及感染了c-Myc-ER诱导系统的小鼠胚胎成纤维细胞(MEFs)的RNA- seq和ChIP-seq数据分析表明,c-Myc癌基因以一种依赖于环境的方式直接调控不同的脂肪酸延长酶基因。
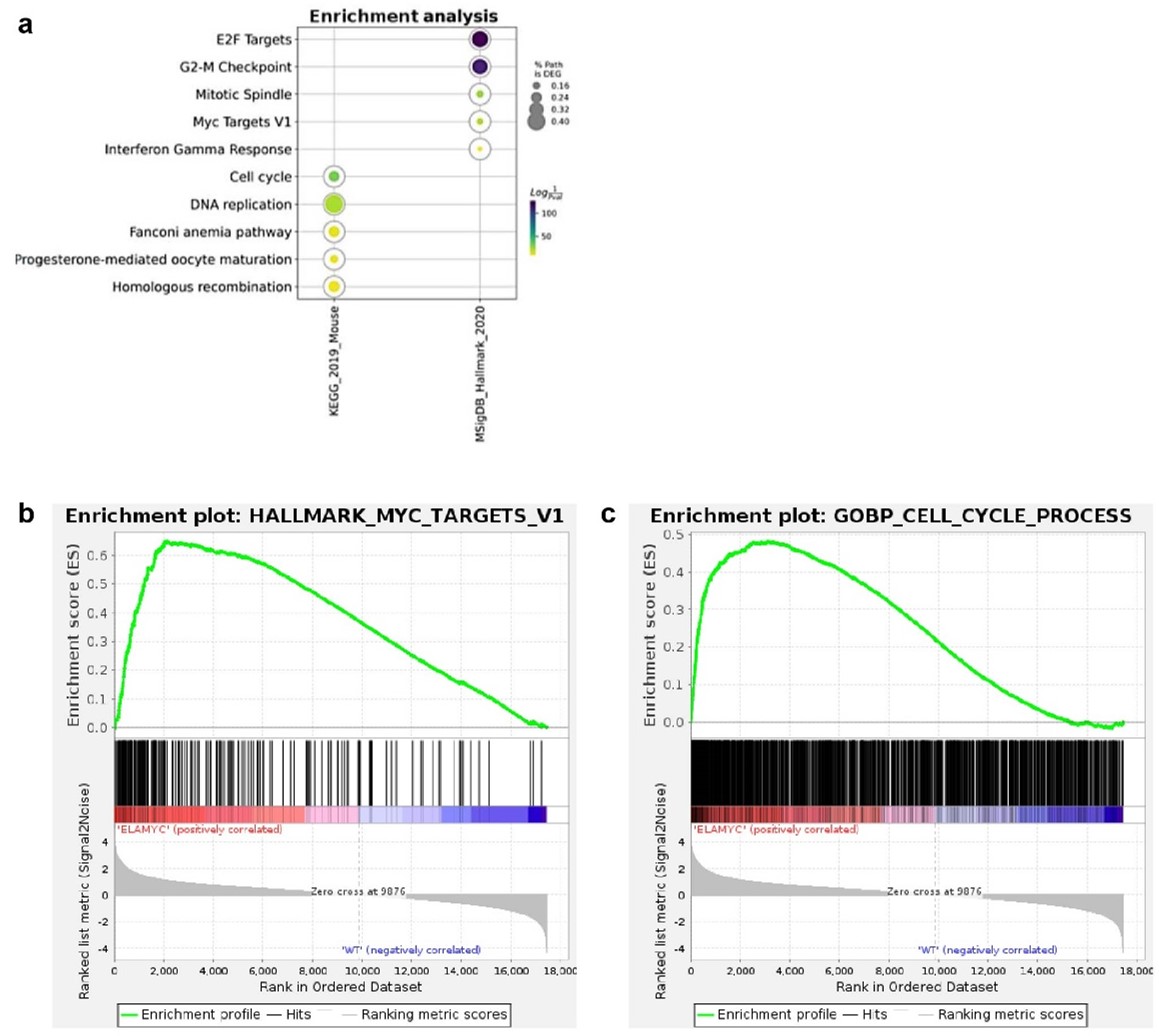
Ela1-Myc小鼠模型中富集的通路
为研究Elovls在腺泡-导管化生(ADM)及转化过程中的作用,研究人员分析了Ptf1a-CreER、LSL-Kras-G12D、LSL-tdTomato(PRT)小鼠模型的单细胞 RNA 测序(scRNA-seq)数据,结果表明Elovls参与从腺泡细胞到完全化生细胞的肿瘤进展过程,在不同细胞类型中有不同作用,并强调了Elovl6和Elovl7在肿瘤微环境中的潜在重要性。Eµ-Myc小鼠模型有助于研究从癌前阶段到肿瘤阶段的疾病进展。研究人员分析了年轻非转基因(对照,C)和Eµ-Myc转基因同窝小鼠(癌前,P)的B细胞,以及成年Eµ-Myc小鼠发生的淋巴瘤(肿瘤,T)的转录组谱,并结合ChIP-seq数据,发现c- Myc通过直接与多个Elovls基因的启动子结合来诱导其表达,并且在细胞转化和肿瘤进展过程中,这种诱导作用会增强。
研究人员在PDAC的癌症基因组图谱(TCGA)中研究 ELOVLs基因的表达情况,与正常组织相比,ELOVL1、ELOVL5和ELOVL6在PDAC中均呈现出显著的过表达,其中ELOVL6的过表达最为突出。这种模式在各个肿瘤阶段都持续存在,使得PDAC成为ELOVL6过表达的少数几种肿瘤之一。研究人员通过由24个PDAC肿瘤样本和11个未经任何治疗的对照胰腺样本组成的scRNA-seq独特队列来验证这一论述;同时利用UMAP分析,观察到ELOVL6是唯一局限于肿瘤区域的酶,这凸显了其在PDAC中的潜在相关性。
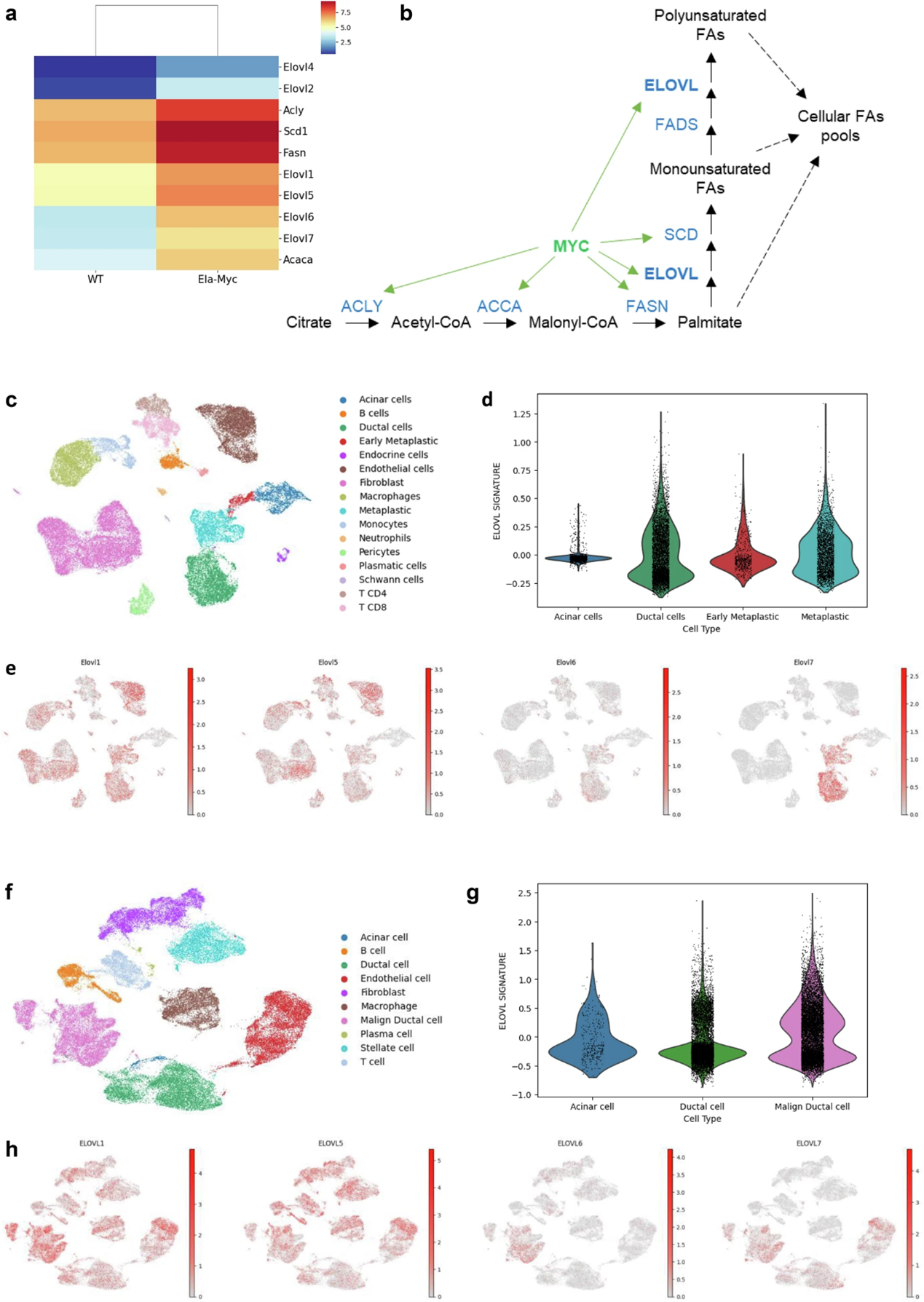
ELOVLs在胰腺导管腺泡中过度表达
研究人员对通过基因或化学方法抑制ELOVL6后的T3M4细胞,采用质谱法进行了脂质组学分析,并重点关注了磷脂酰乙醇胺(PE),这是生物膜不可或缺的一种磷脂。值得注意的是,无论其饱和状态如何(以虚线划分),与对照相比,构成PE的较短链脂肪酸发生积累,而较长链脂肪酸则减少。此外,对生物膜中另一种常见磷脂——磷脂酰胆碱(PC)的平行分析,也产生了类似的结果。
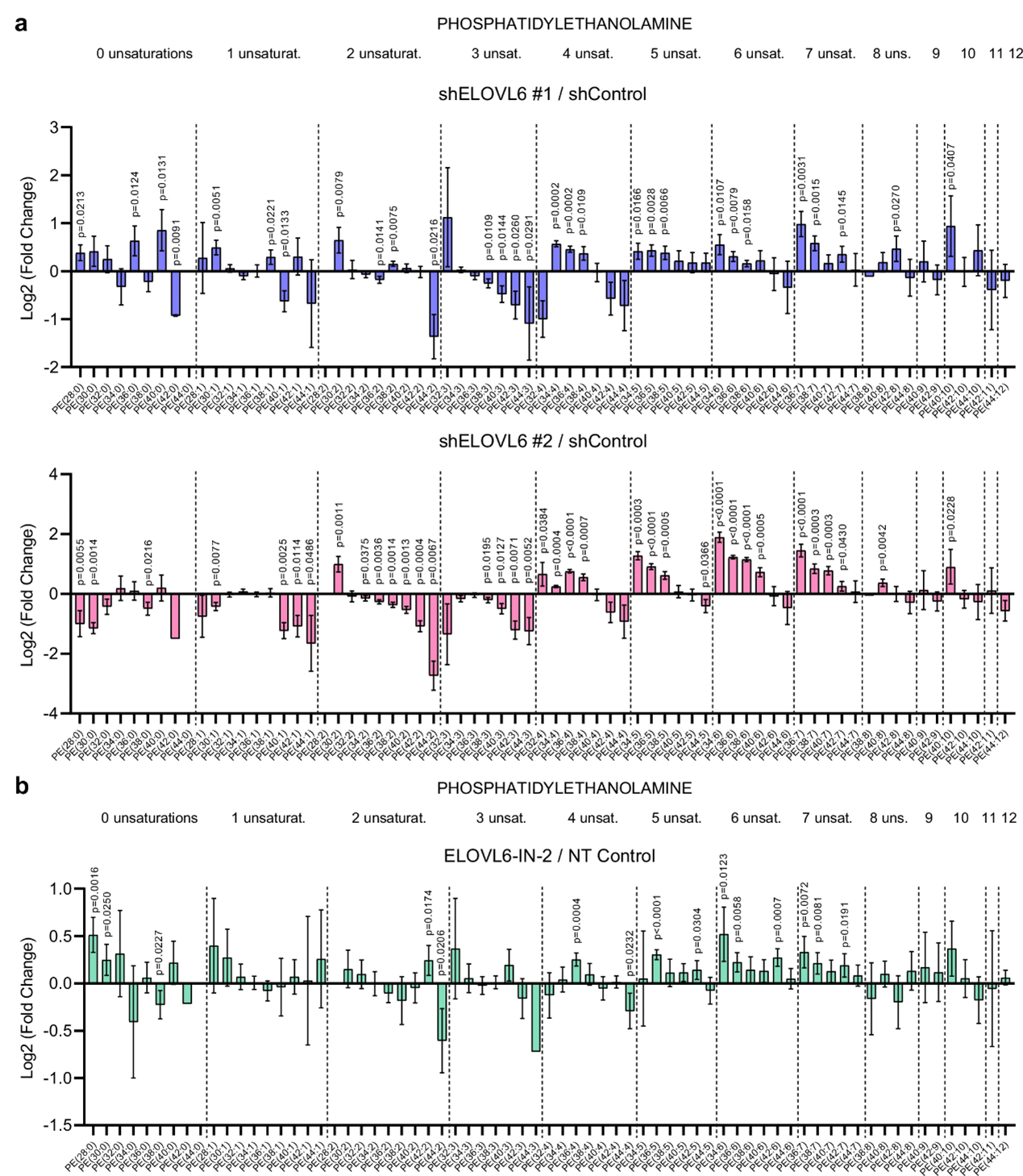
ELOVL6干扰改变脂质组成
研究人员使用U-13C-glucose同位素标记培养基对总脂肪酸组成进行分析,也证实了无论是通过基因还是化学方法干扰ELOVL6,都会对脂肪酸代谢产生影响。为了进一步证实ELOVL6干扰后观察到的结果,研究人员还分析了降低其高c-MYC表达水平的T3M4细胞中的总脂肪酸组成,得到了与ELOVL6沉默或抑制相似的结果。这些结果表明,对ELOVL6进行基因或化学抑制,会对细胞内的脂质组学格局产生深远影响。这一全面的认识强调了ELOVL6在协调脂质代谢中的关键作用,并突出了其在调节细胞膜组成方面的重要意义。
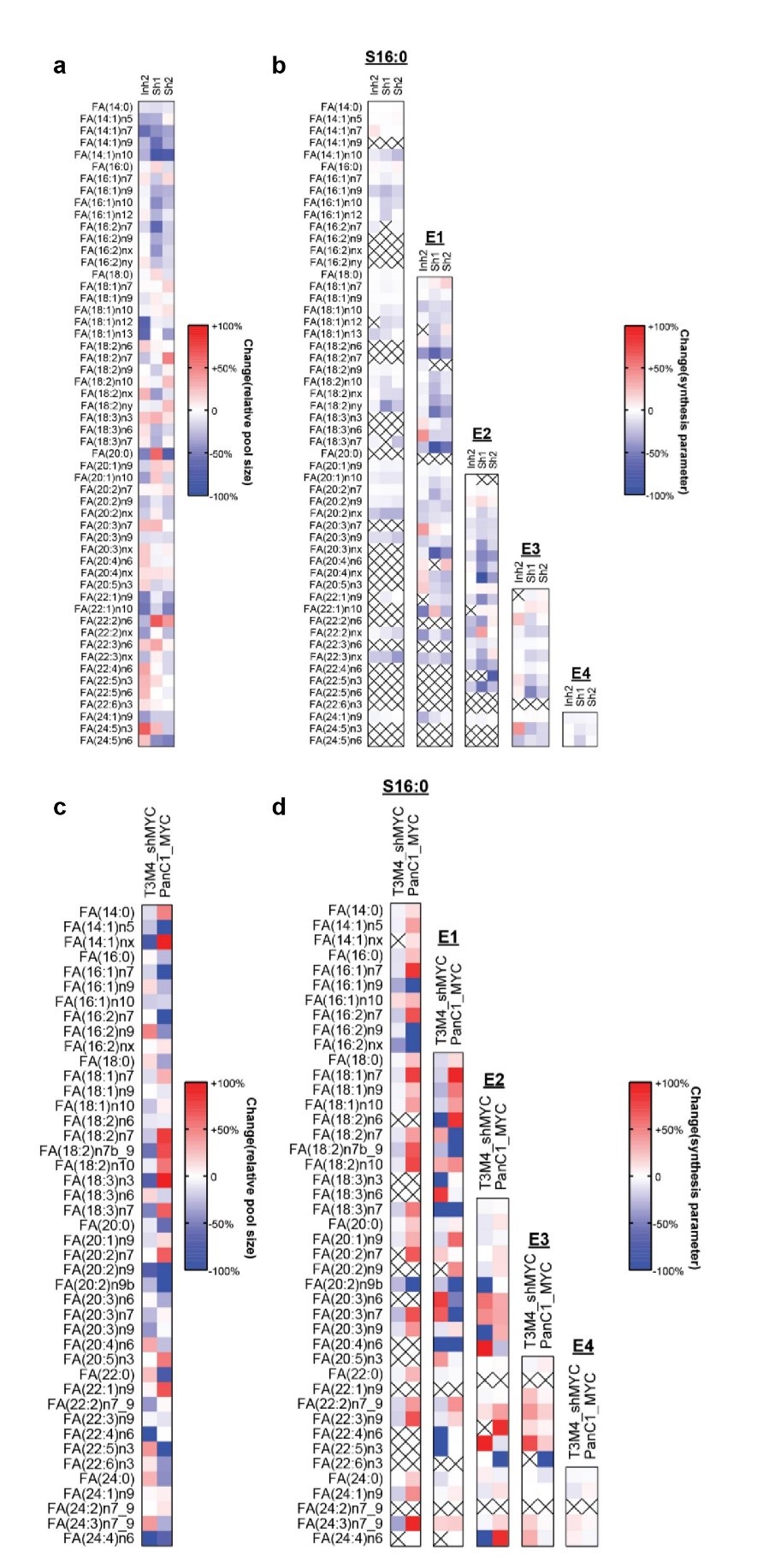
脂肪酸代谢分析
通过细胞增殖、集落生长以及Transwell检测等实验表明,对ELOVL6进行基因或化学抑制,会改变脂肪酸组成,进而影响细胞膜的刚性、通透性和胞饮作用,最终降低肿瘤细胞的增殖和迁移能力。这些变化会增加肿瘤细胞对白蛋白结合型紫杉醇(Abraxane)的摄取,并且在体外实验中,与抑制ELOVL6联合使用时显示出协同效应。在体内实验中,干扰ELOVL6的表达可显著抑制肿瘤生长,提高对Abraxane的治疗反应,延长生存期。
综上,该研究结果表明,ELOVL6是一个很有前景的治疗靶点,证明了在PDAC中对其进行化学抑制的有效性。与Abraxane联合治疗产生的协同作用,不仅凸显了提高治疗效果的潜力,还为推进PDAC的治疗策略揭示了一系列可能性。





