Cell metabolism:余秋景团队与王霆团队发现丝氨酸代谢通过阻止ATP6V0d2介导的YAP溶酶体降解抑制抗病毒天然免疫
2021年4月,天津医科大学、中科院遗传与发育生物学研究所、苏州大学、华中科技大学的相关研究人员在《Cell metabolism》上发表了题为“Serine Metabolism Antagonizes Antiviral Innate Immunity by Preventing ATP6V0d2-mediated YAP Lysosomal Degradation”的研究论文,揭示了PHGDH和丝氨酸代谢在削弱抗病毒先天免疫中的关键功能。

病毒感染后SGOC代谢酶被下调
PHGDH抑制和SG饥饿增强了体内和体外的抗病毒先天免疫
SG缺乏通过抑制SAM依赖性H3K27me3来增加ATP6V0d2的表达
ATP6V0d2促进YAP溶酶体降解以增强IFN-β的产生
天生的免疫力是宿主抵抗微生物感染的第一道重要防线。宿主细胞通过不同类型的模式识别受体(PRR)识别病毒RNA和DNA,然后,PRR募集衔接子蛋白以激活TBK1和/或IKKε激酶。TBK1 /IKKε使IRF3和核因子κB(NF-κB)磷酸化以诱导其核易位并随后转录I型干扰素(包括IFN-α和IFN-β)和炎性细胞因子。与IFN受体结合后,I型IFN激活JAK-STAT信号传导并促进干扰素刺激基因(ISG)的表达,以对抗病毒感染和协调适应性免疫。越来越多的证据表明,胆固醇和葡萄糖代谢网络与先天性免疫激活共同调节,以控制病毒感染。然而,其他宿主代谢活动如氨基酸代谢是否以及如何参与抗病毒天然免疫尚不清楚。
丝氨酸是一种参与细胞增殖的非必需氨基酸。丝氨酸的从头合成过程中,糖酵解衍生的3-PG最终可以通过一系列酶促反应转化为丝氨酸,其第一个关键步骤是由磷酸甘油酸脱氢酶(PHGDH)催化。丝氨酸促进一碳代谢,包括相互连接的代谢途径网络,促进一碳单位的转移,用于核苷酸、S-腺苷甲硫氨酸(SAM)、NADPH和谷胱甘肽(GSH)的生物合成。丝氨酸可通过巨噬细胞中GSH合成或SAM介导的组蛋白甲基化促进脂多糖(LPS)介导的白细胞介素(IL)-1β产生。然而,PHGDH介导的丝氨酸合成途径(SSP)或外源性丝氨酸是否参与抗病毒天然免疫仍不清楚。
液泡型H+腺苷三磷酸酶(V-ATPase)是一种依赖于ATP的质子泵,由水解ATP的外围V1结构域和转运质子的完整结构域组成。V-ATP酶定位于多种细胞膜上,酸化细胞内室,包括内体和溶酶体。V-ATPase或其亚单位ATP6V0d2参与调节多种生物过程,包括蛋白质降解、促进甲型流感病毒融合或消除细菌感染。然而,V-ATPase在抗病毒免疫中的作用目前尚不清楚。Hippo通路在器官大小控制和组织稳态中起着关键作用。当该途径被激活时,Lats1/2激酶磷酸化YAP/TAZ,将它们保留在细胞质中进行泛素化和降解。然而,一个特定的代谢途径是否能与Hippo-YAP途径相互作用以调节抗病毒天然免疫,目前尚不清楚。
丝氨酸、甘氨酸、一碳(SGOC)代谢已被表征为各种类型肿瘤细胞和效应T细胞的代谢特征。研究人员首先分析了病毒感染后巨噬细胞SGOC代谢网络的动态变化,结合qPCR及LC-MS / MS代谢组学分析,发现病毒感染能显著抑制参与SSP的基因表达及代谢物的产生。研究人员进一步探究PHGDH在抗病毒先天免疫中发作用,发现PHGDH在各种细胞类型中均负调节由RNA或DNA病毒诱导的IFN-γ信号传导,其机制是通过抑制TBK1-IRF3轴阻止IFN-γ的产生。

PHGDH通过抑制TBK1-IRF3轴负调控IFN-β信号传导
接着,研究人员通过PHGDH酶活性失活突变体证实了PHGDH的酶活性对于抑制病毒诱导的TBK1-IRF3活化是必不可少的,PHGDH的选择性小分子酶抑制剂CBR-5884也显着增强了病毒诱导的IFN-γ表达,表明PHGDH介导的SSP破坏了抗病毒反应。此外,限制外源性丝氨酸和甘氨酸的摄取,也可以增强IFN-β介导的体内外抗病毒先天免疫。这些结果表明丝氨酸代谢通过TBK1-IRF3轴抑制了IFN-β的诱导。
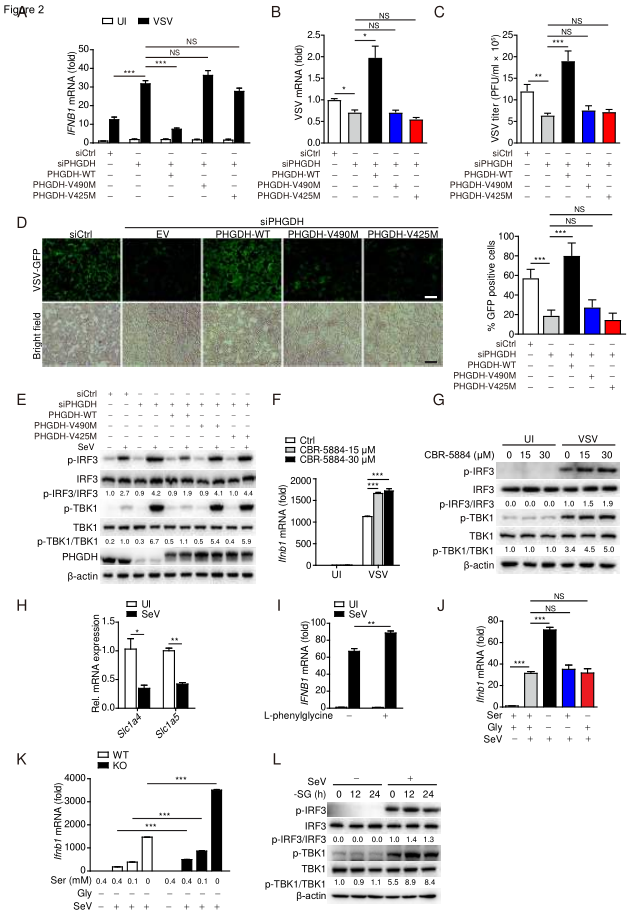
丝氨酸代谢抑制IFN-β介导的细胞抗病毒活性
随后,研究人员进一步探究PHGDH在体内抗病毒免疫中的功能,PHGDH敲除(PHGDH-KO-Mφ)小鼠表现出增强了的抗病毒的先天免疫。PHGDH抑制剂CBR-5884预处理的小鼠血清中病毒诱导的IFN-β分泌显著高于媒介物处理的小鼠,肝脏中病毒特异性mRNA和病毒滴度明显降低,肺部损伤更少。表明PHGDH的酶活性对于它在体内抑制抗病毒的先天免疫是至关重要的。此外,外源性丝氨酸摄入限制能增强小鼠的抗病毒先天免疫,高丝氨酸饮食则有相反的效果。这些结果表明,通过减少内源性丝氨酸的生物合成或外源性丝氨酸的摄取来抑制丝氨酸代谢会增强抗病毒的先天免疫应答。

抑制丝氨酸代谢可保护小鼠免受病毒感染
研究人员随后探讨了哪些丝氨酸/甘氨酸(SG)衍生的代谢物可能是抑制抗病毒天然反应的原因。有趣的是,在缺乏丝氨酸的情况下,添加甲酸盐或GSH并不能明显降低HEK293T细胞中增强的病毒诱导的IFNB1 mRNA。然而,SAM的加入显著降低了SG缺失细胞增加的IFNB1 mRNA和TBK1–IRF3激活,达到了病毒感染后对照细胞的水平。PHGDH缺乏显著降低了SAM的细胞内水平, 但没有降低丝氨酸水平。U- [13C]-葡萄糖示踪发现,与从头合成丝氨酸相比,病毒感染可能导致其他来源的丝氨酸减少(例如丝氨酸吸收),其他来源的丝氨酸促进的SAM生成也可能减少。进一步研究发现,外源丝氨酸和SAM的添加显着降低了IFNB1 mRNA的表达。这些结果表明,源自丝氨酸代谢的SAM对于抑制抗病毒先天免疫应答至关重要。
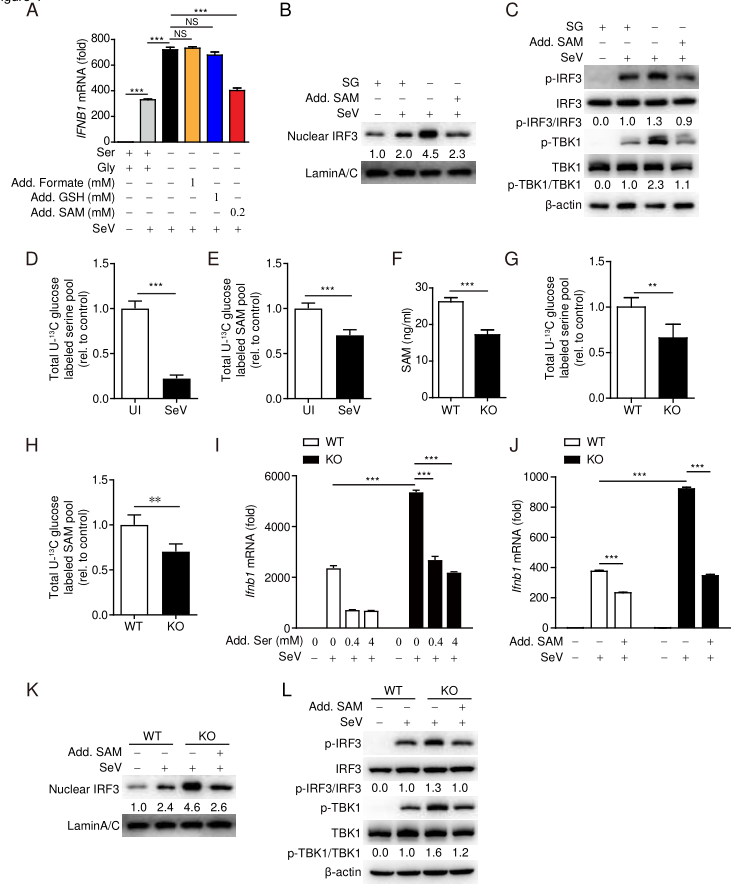
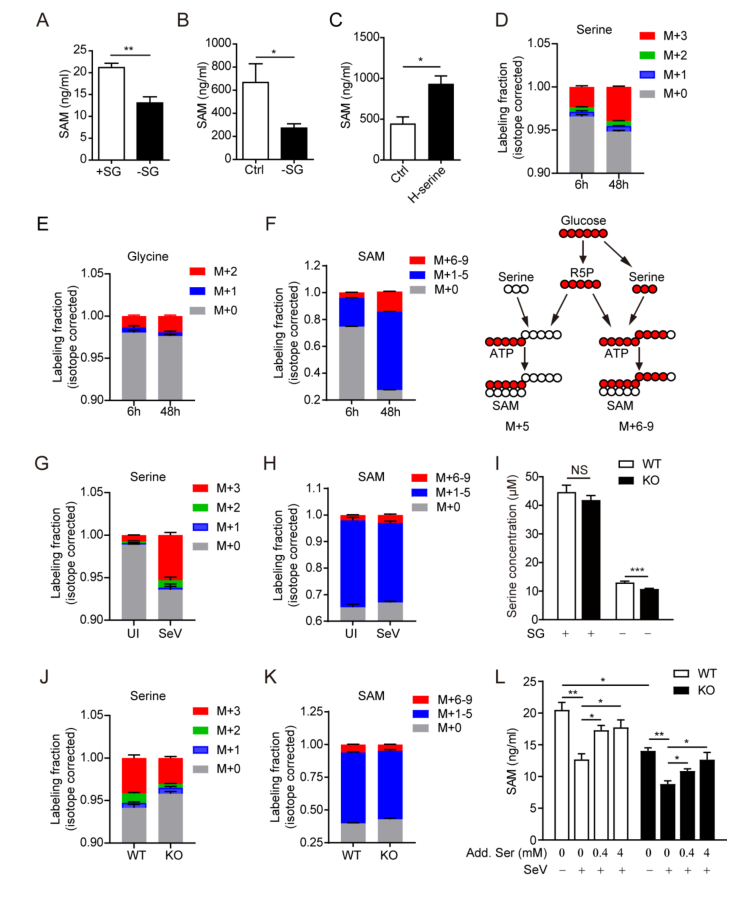
丝氨酸代谢衍生的SAM削弱了IFN-β的产生
研究人员接着探究了PHGDH抑制抗病毒先天免疫的潜在机制,发现丝氨酸代谢可以通过增加SAM依赖的启动子H3K27me3丰度来抑制Atp6v0d2转录。ATP6V0d2是IFN-β介导的抗病毒天然免疫所必需的,PHGDH至少部分通过ATP6V0d2抑制TBK1–IRF3信号和IFN-β产生。
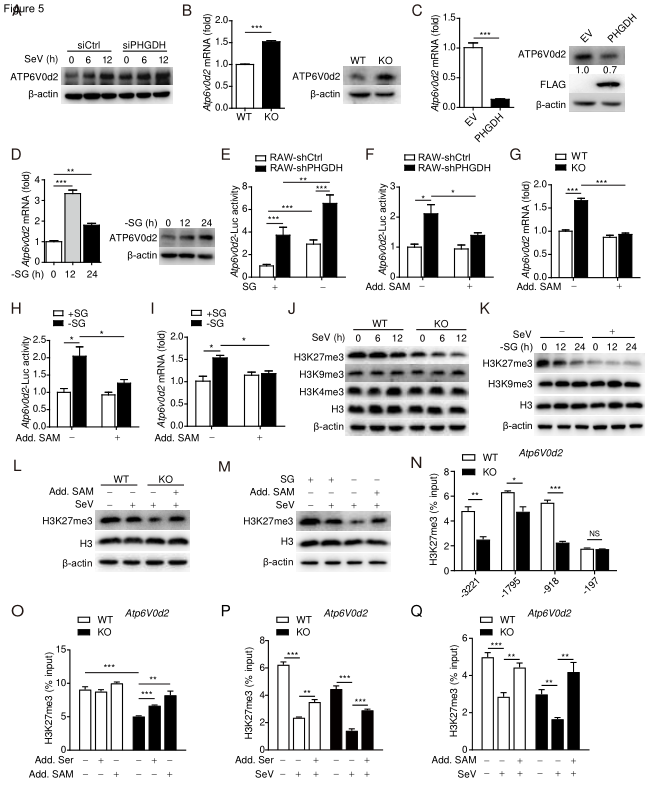
PHGDH通过增加启动子上的SAM依赖性H3K27me3占用来降低ATP6V0d2的表达
ATP6V0d2对溶酶体介导的HIF-2α降解至关重要。在病毒感染后,YAP通过IKK介导的磷酸化作用靶向溶酶体降解,并且YAP通过抑制TBK1或IRF3激活负性调节IFN-β介导的抗病毒天然免疫。最后,研究人员探究了ATP6V0d2对 YAP表达的影响以及PHGDH是否通过ATP6V0d2在病毒诱导的YAP溶酶体降解中发挥作用。结果发现,ATP6V0d2在病毒感染时通过促进YAP的溶酶体降解,以减弱YAP介导的TBK1-IRF3轴抑制,诱导IFN-β的产生。丝氨酸代谢可通过阻止ATP6V0d2介导的YA P溶酶体降解来抑制抗病毒先天免疫。
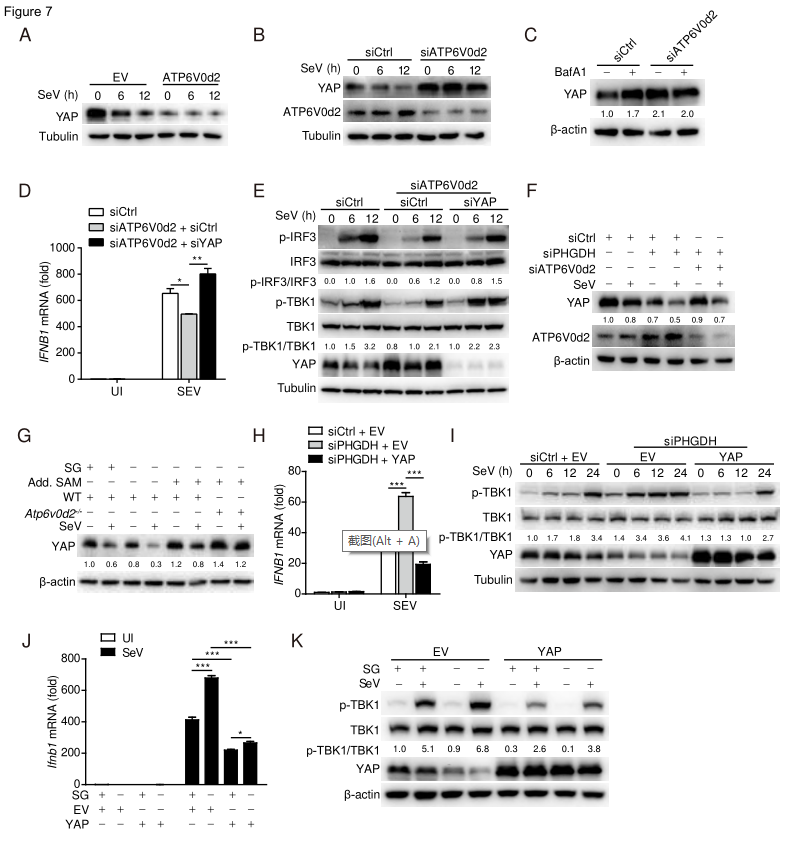
ATP6V0d2通过促进YAP的溶酶体降解来诱导IFN-β的产生
综上所述,该研究发现揭示了以前未知的代谢基因PHGDH和重要的免疫代谢物丝氨酸对抗抗病毒活性的功能,并指出了在病毒感染的临床治疗中可能的应用。






