Cell Metabolism:诱导定时代谢崩溃以克服癌症的化学耐药性
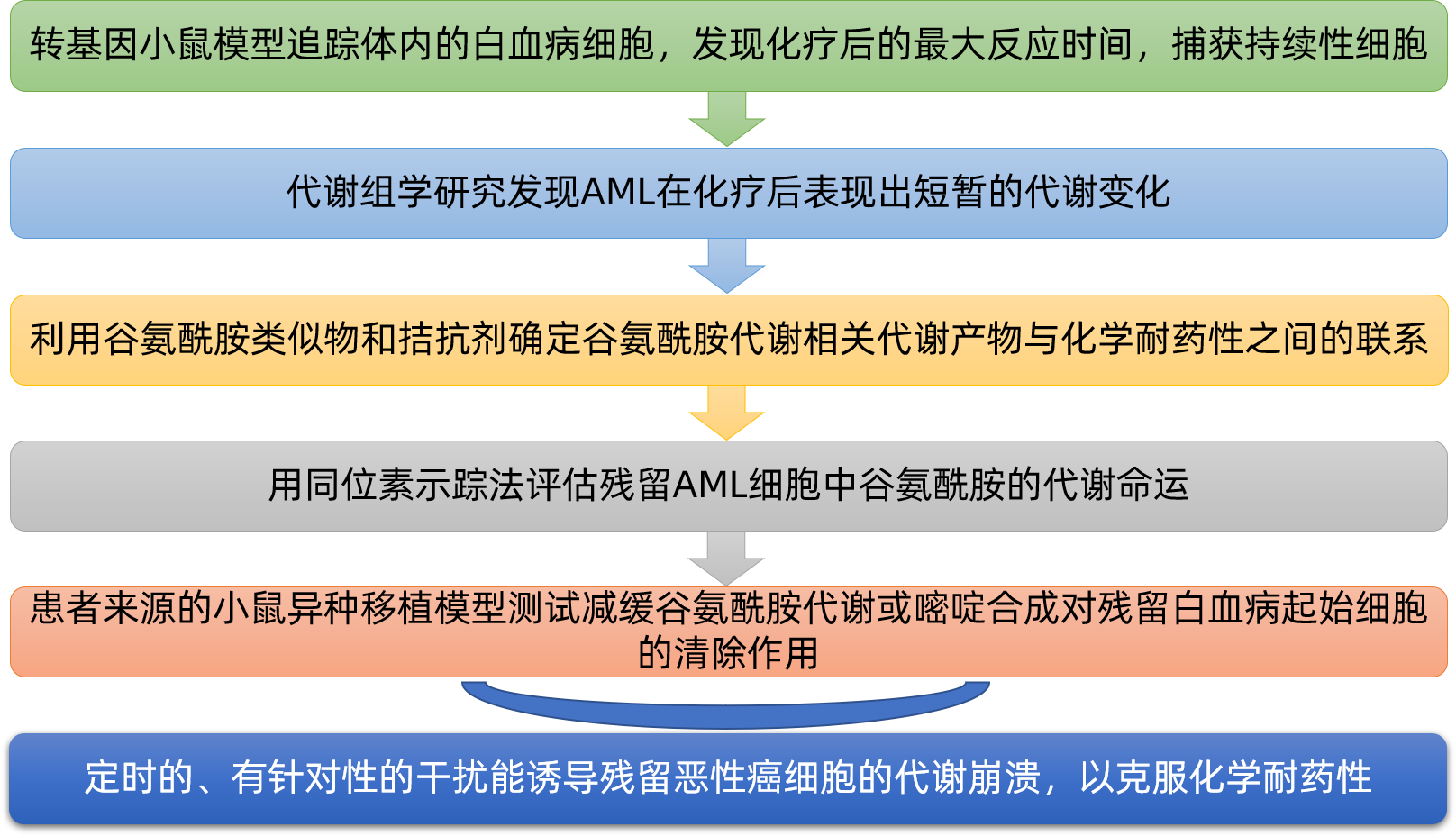
2020年8月,哈佛大学、麻省总医院、哈佛医学院等单位的相关研究人员在《Cell Metabolism》(IF: 21.57)上发表了题为“Induction of a Timed Metabolic Collapse to Overcome Cancer Chemoresistance”的研究论文,发现定时的、有针对性的干扰能诱导残留恶性癌细胞的代谢崩溃,以克服化学耐药性。

非靶向代谢组学揭示了AML细胞的体内代谢特征。
AML细胞对化学疗法有短暂的代谢变化。
LepR +基质细胞提供天冬氨酸以支持AML细胞生成嘧啶。
根据进化生物学,当一个群体遭受压力事件或“瓶颈”时,只有具有适应能力的个体才能生存。细胞群的行为也类似,这解释了癌症的克隆进化。急性髓细胞性白血病(AML)是一种高度致死性的造血系统癌症,其中残留克隆会通过治疗持续存在并最终导致复发。与正常细胞相比,AML细胞具有独特的代谢依赖性,代谢网络为细胞赋予了与转录变化无关的进化-古代应激保护系统,提供了应对外源压力的一线防御机制。
当恶性细胞经过化学疗法和周围区域大量细胞死亡的副产物引起的极端代谢瓶颈时,癌症复发就开始了。在临床上癌症复发明显时,它不会反映在复发细胞中,因为大部分局部环境和细胞内的失衡将重新平衡。相反,它只能在从体内提取的细胞中观察到,在这种情况下,细胞死亡达到最大程度,化疗副产物正在被清除。其特征是出现导致复发的白血病再生细胞。确定这些持续性细胞的代谢依赖性可能揭示出一些可以被治疗利用的弱点。
研究人员使用三重转基因小鼠模型追踪体内的白血病细胞,发现化疗后的最大反应时间后,捕获了持续性细胞,并进行无偏代谢组学研究,发现AML在化疗后表现出短暂的代谢变化。代谢途径富集分析显示,相关的“谷氨酰胺和谷氨酸代谢”和“丙氨酸,天门冬氨酸和谷氨酸代谢”是区分诱导化疗(iCT)处理的细胞与赋形剂对照组细胞的和复发细胞的主要途径。这些途径中的谷氨酰胺、谷氨酸和天冬氨酸是中心代谢产物,在赋形剂对照组细胞中较低,在对iCT产生最大反应时残留细胞中较高,而在复发后又较低,表明这些代谢产物在化疗的即时应激反应中起作用。
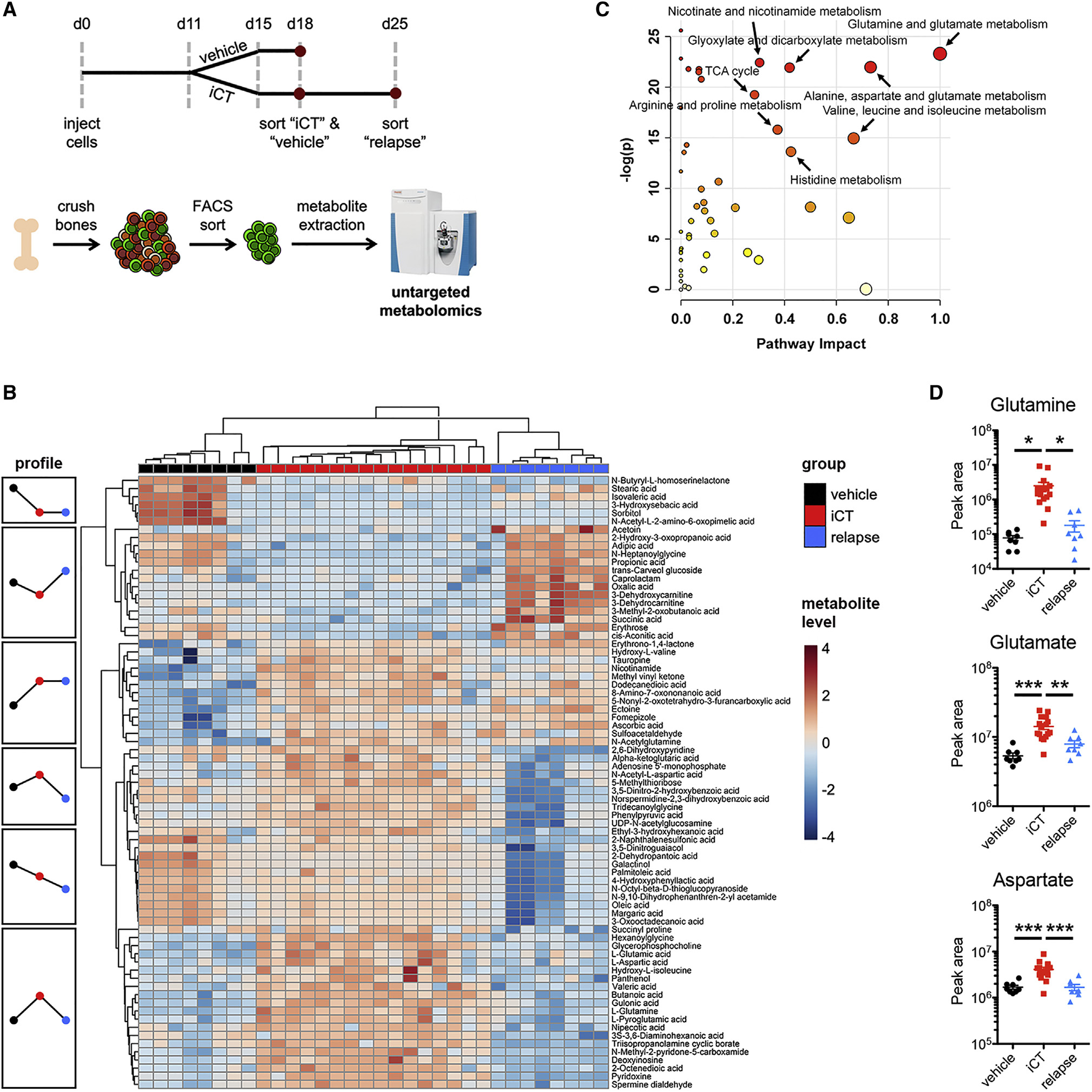
为了确定谷氨酰胺相关代谢产物的增加是否会引起化学耐药性,研究人员使用谷氨酰胺类似物和拮抗剂6-重氮-5-氧代-L-正亮氨酸(6-Diazo-5-oxo-L-norleucine,DON)评估了残留的AML细胞是否更易受到谷氨酰胺代谢的广泛抑制。结果表明,谷氨酰胺代谢的激活在化疗后的最大应激时保护AML细胞,并揭示了定时抑制谷氨酰胺代谢以消除持续性AML细胞的潜力。此外,除了谷氨酰胺转运蛋白外,在代谢产物水平上观察到的残留AML细胞中谷氨酰胺代谢的瞬时增加并未反映在mRNA水平上。
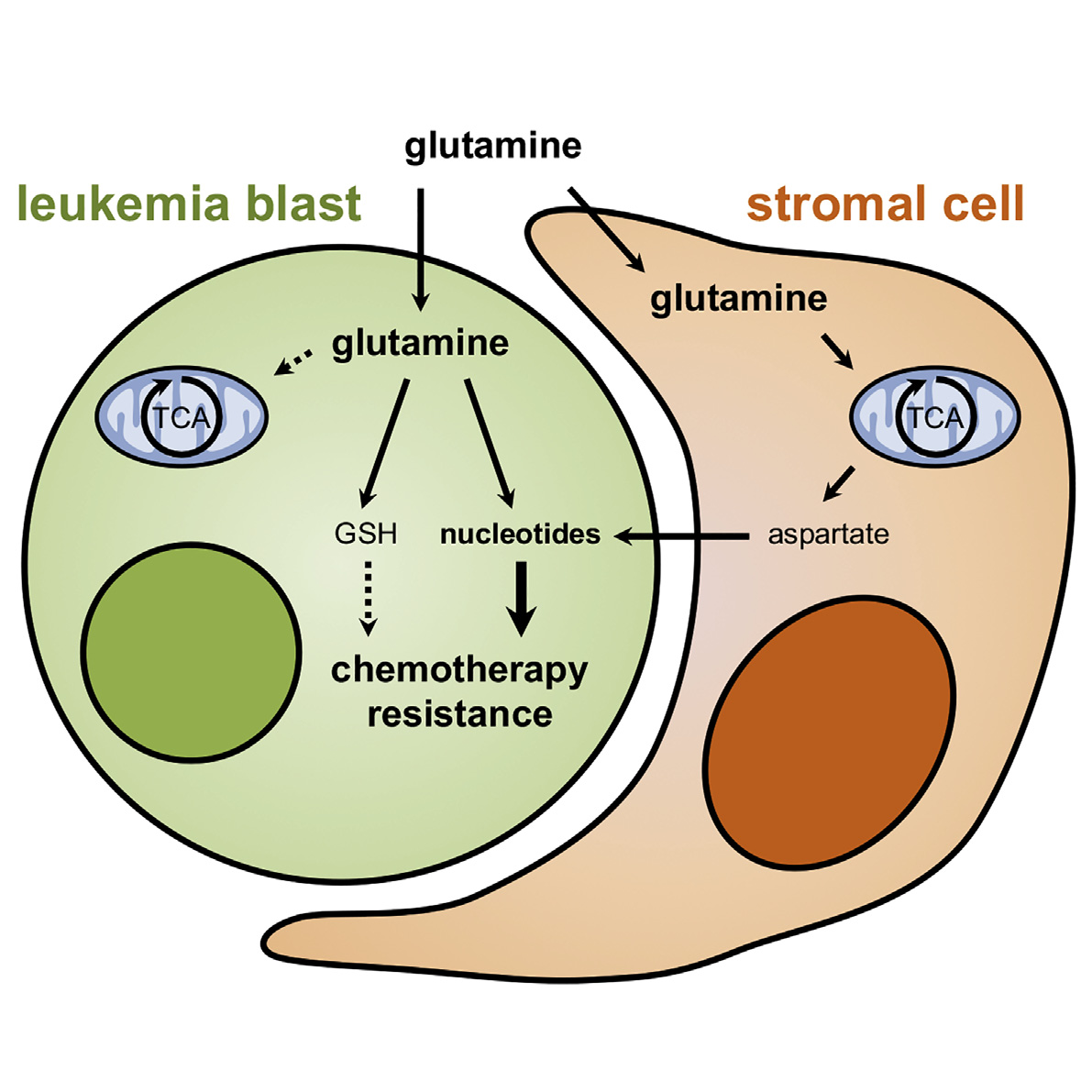
接着,研究人员用体内同位素示踪法评估残留AML细胞中谷氨酰胺的代谢命运,发现持续性细胞以独特的方式使用谷氨酰胺,优先为嘧啶和谷胱甘肽的生成提供能量,而不是线粒体三羧酸循环。谷氨酰胺或嘧啶代谢抑制剂可有效地靶向化疗后持续存在的白血病起始细胞。值得注意的是,恶性细胞嘧啶的合成也需要特定骨髓基质细胞提供天冬氨酸。
最后,研究人员进行了将该发现转化为临床的先期测试,发现减缓谷氨酰胺代谢或嘧啶合成以对抗残留白血病起始细胞,可提高白血病小鼠模型和患者来源异种移植物的存活率。
综上所述,该研究定义了AML细胞经过强烈选择压力时的代谢特征。研究人员发现残留的AML细胞表现出短暂的代谢适应性,从而驱动其对化学疗法的抵抗力,并在AML小鼠模型中显示出定时操纵特定代谢途径(如谷氨酰胺代谢和嘧啶合成)具有治疗潜力。这些发现强调了细胞代谢作为一种原始的一线应激保护机制的重要性,该机制可以靶向消除化学耐药性癌细胞。
常州中科脂典生物技术有限责任公司
Bridging Metabolome and Health
地址:常州市新北区梅山路3号科技转化楼6楼北
电话:0519-82018180
邮编:213125
邮箱:sales@lipidall.com
服务热线: 0519-82018180
微 信 公 众 号
微 信 客 服 号
©2018 常州中科脂典生物技术有限责任公司 苏ICP备17014106号






