Nature Medicine:COVID-19的肺外表现
2020年7月,纽约长老会/哥伦比亚大学欧文医学中心等单位的相关研究人员在《Nature Medicine》上发表了题为“Extrapulmonary manifestations of COVID-19”的长篇综述,回顾了COVID-19患者肺外器官特异性的病理生理学、表现和治疗注意事项,以帮助临床医生和科学家为所有相关器官系统制定研究重点和治疗策略。

回顾总结了COVID-19整体的病理生理学,涉及直接病毒毒性、内皮细胞损伤和血栓炎症免疫反应异常、RAAS失调。
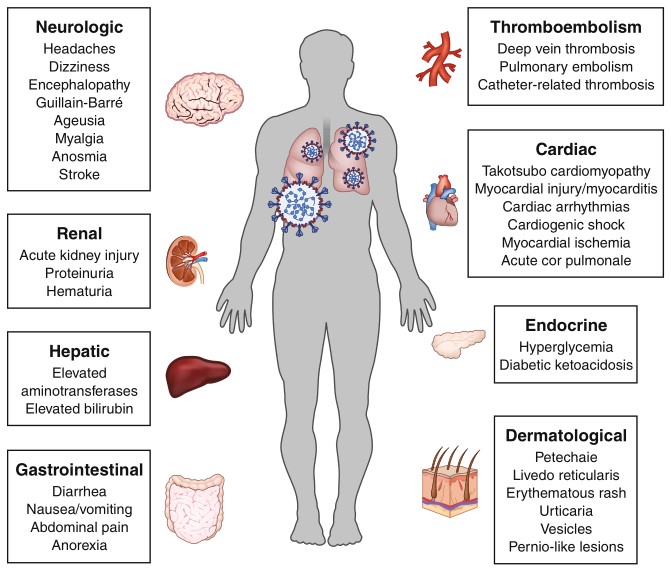
从流行病学和临床表现、病理生理学、病人管理注意事项多维度系统性总结了COVID-19的肺外表现,涵盖血液学、心血管、肾脏、胃肠道、肝胆、内分泌、神经和眼科、皮肤科。
回顾总结了儿童和孕妇这类特殊病人COVID-19的流行病学和临床特征。
冠状病毒SARS-CoV-2(严重急性呼吸系统综合症冠状病毒2)是导致COVID-19病(2019年冠状病毒病)的原因。虽然已知SARS-CoV-2会导致严重的肺部疾病,包括肺炎和急性呼吸窘迫综合征(ARDS),但临床医生已经观察到了COVID-19的许多肺外表现。临床经验和最新文献表明,血液,心血管,肾脏,胃肠和肝胆,内分泌,神经,眼科和皮肤科系统均可受到影响。这种病理可能反映了SARS-CoV-2在肺外的传播和复制,正如其他人畜共患型冠状病毒所观察到的那样,也可能反映了该疾病的广泛免疫病理后遗症。
为了提供这些肺外表现的观点,研究人员讨论了COVID-19对各种器官系统的病理生理学和临床影响,并结合纽约市哥伦比亚大学欧文医学中心在大流行的震中所取得的经验。
本篇主要呈现COVID-19的整体病理生理学和内分泌(代谢)方面的表现。

病理生理学
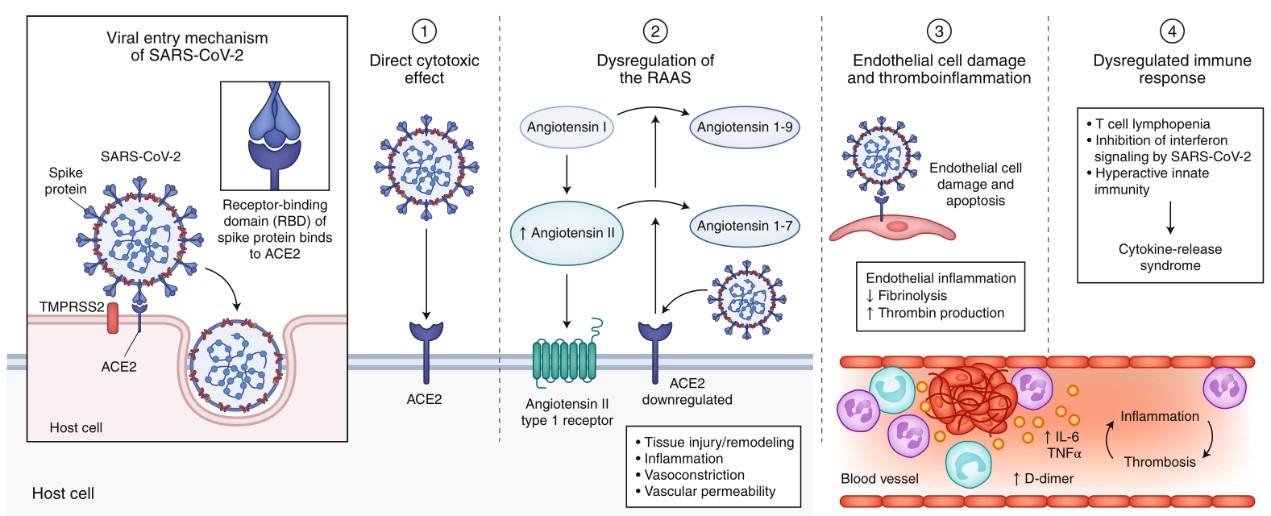
图1. COVID-19的病理生理学
SARS-CoV-2采用的受体识别机制似乎与以前的强力冠状病毒(如SARS-CoV)类似,后者是2003年SARS流行的病原体。冠状病毒刺突蛋白促进病毒进入靶细胞。SARS-CoV的刺突亚基和SARS CoV-2的刺突亚基与ACE2(血管紧张素转换酶2)结合作为进入受体。此外,细胞进入需要通过细胞丝氨酸蛋白酶TMPRSS2或其他蛋白酶引发刺突蛋白。完成进入过程需要在ACE2和TMPRSS2的细胞表面上共表达。此外,如SARS-CoV的研究显示,病毒与ACE2结合的效率是传播能力的关键决定因素。最近的研究表明,SARS-CoV-2与ACE2的结合亲和力比SARS-CoV与ACE2的结合亲和力更高,这可能部分解释了SARS-CoV-2的可传递性更强。
SARS-CoV-2感染继发的多器官损伤的病理生理学中可能起作用的关键机制包括直接病毒毒性、内皮细胞损伤和血栓炎症、免疫反应失调和肾素-血管紧张素-醛固酮系统(RAAS)调节失调。这些机制在COVID-19的病理生理学中的相对重要性目前还不完全清楚。虽然其中一些机制,包括ACE2介导的病毒进入和组织损伤,以及RAAS的失调,可能是COVID-19所独有的,但由系统性细胞因子释放和微循环障碍引起的免疫机制也可能继发于败血症。
SARS-CoV-2主要通过直接或间接呼吸道接触传播。由于其入口受体ACE2在多种气道上皮细胞(包括肺实质的肺泡上皮II型细胞)中的高表达,它对呼吸道具有向性。用RT-PCR方法成功地检测了SARS-CoV-2活病毒和上呼吸道病毒亚基因组mRNA。在病程后期,病毒复制可能发生在下呼吸道,严重者表现为肺炎和ARDS。
评估SARS-CoV-2特定部位病毒复制的研究已有从粪便样本中分离出高滴度的病毒RNA,而从尿液和血液中分离的病毒RNA则较少。组织病理学研究报告了SARSCoV-2在呼吸道以外的器官向性,包括对肾脏、心肌、神经、咽部和胃肠组织的向性。此外,单细胞RNA测序研究证实了ACE2和TMPRSS2在肺泡上皮II型细胞、鼻杯状分泌细胞、胆管细胞、结肠形成细胞、食管角质形成细胞、胃肠上皮细胞、胰腺β细胞、肾近端小管和足细胞中的表达。这些发现表明,多器官损伤至少部分是由于病毒组织的直接损伤。SARS-CoV-2的肺外传播机制,无论是血源性的还是其他的,仍不清楚。
ACE2介导的SARS-CoV-2进入导致的内皮细胞损伤和随后的炎症以及血栓形成环境的产生是COVID-19的其他病理生理机制。ACE2在多个器官的动静脉内皮细胞中均有表达,组织病理学研究在肾和肺的内皮细胞中发现了SARS-CoV-2病毒颗粒的微观证据。感染介导的内皮损伤(以血管性血友病因子水平升高为特征)和内皮炎(以活化的中性粒细胞和巨噬细胞的存在为特征),在COVID-19患者的多个血管床(包括肺、肾、心脏、小肠和肝脏)中发现,可引发过度凝血酶生成,抑制纤维蛋白溶解并激活补体途径,引发血栓炎症,最终导致微血栓沉积和微血管功能障碍。
血小板-中性粒细胞的交叉通讯和巨噬细胞的激活可促进多种促炎作用,如细胞因子释放、中性粒细胞胞外杀菌网络(NETs)的形成以及纤维蛋白和/或微血栓的形成。NETs进一步损伤内皮细胞,激活外源性凝血途径和内源性凝血途径。在美国一家大型学术中心的一项研究中,在住院COVID-19的患者中检出的血红蛋白水平较高(50名患者和30名对照组参与者),其“促NET状态”与疾病的严重程度呈正相关。急性肺损伤后缺氧介导的高粘血症和HIF-1(缺氧诱导因子1)信号通路的上调也可能是血栓形成的原因。最后,冠状病毒介导的直接作用也可能导致促凝血和抗凝血途径失衡。病例报告和病例系列研究表明,在COVID-19患者的组织病理学检查中存在纤维蛋白渗出物和微血栓。
严重COVID-19的表现是由于先天免疫过度激活而导致的免疫反应失调和细胞因子释放综合征。之前对致病性人冠状病毒进行的临床前和人体研究提出,病毒快速复制,拮抗干扰素信号,激活中性粒细胞和单核巨噬细胞作为炎症的介质。血清炎症标志物如C-反应蛋白、铁蛋白、血沉、D-二聚体、纤维蛋白原和乳酸脱氢酶的升高预示着COVID-19患者随后的严重疾病和死亡。这些异常指标已与继发性噬血细胞性淋巴组织细胞增多症-巨噬细胞活化综合征进行了比较,先前在死于SARS-CoV感染的患者的病理样本中证实了这一点。血清中较高水平的细胞因子IL-6与COVID-19患者更差的预后有关,并被发现与纤维蛋白原水平有关。通过靶向IL-6信号通路治疗COVID-19的临床试验正在进行中,希望能减轻该通路激活的有害影响。
RAAS的适应不良功能构成了SARS-CoV-2感染相关组织损伤的另一个可能的病理生理机制。RAAS由一系列调节肽组成,这些肽参与机体的关键生理过程,包括液体和电解质平衡、血压调节、血管通透性和组织生长。ACE2是一种膜结合的氨基肽酶,已成为RAAS途径的有效反调节剂。ACE2将血管紧张素I裂解为无活性的血管紧张素,并将血管紧张素II裂解为具有血管扩张,抗增殖和抗纤维化特性的血管紧张素。尽管SARS-CoV-2的病理生理学可能不仅限于与ACE2相关的途径,但这些发现可能对COVID-19的器官特异性临床表现有意义。
内分泌学表现
糖尿病和/或肥胖患者有发展更严重COVID-19疾病的风险。在美国疾病控制中心的一份报告中,24%的住院病人和32%的ICU病人有潜在的糖尿病。在纽约市一家三级护理医院住院的257名危重病人中,36%患有糖尿病,46%患有肥胖症。在中国和意大利的研究中也有类似的观察结果,这些研究表明潜在的糖尿病与严重疾病和死亡有关联。此外,接受COVID-19治疗的患者出现了一系列葡萄糖代谢异常,包括恶化的高血糖症、血糖正常的酮症和典型的糖尿病酮症酸中毒。在一项来自中国的回顾性研究中,在658例COVID-19患者中,6.4%的患者在没有发烧或腹泻的情况下出现酮症。其中,64%的人没有潜在的糖尿病(该组平均血红蛋白A1c水平为5.6%)。
在COVID-19和糖尿病患者中观察到的包括恶化的高血糖和酮症在内的更严重的疾病过程可能是几种机制造成的。与SARS-CoV-2相关的因素包括细胞因子水平显着升高,这可能导致胰腺β细胞功能和细胞凋亡受损,从而导致胰岛素生成和酮症减少。另外,ACE2表达已在内分泌胰腺中被报道。这增加了SARS-CoV-2与β细胞上ACE2的直接结合可能导致胰岛素缺乏和高血糖症的可能性,正如先前对SARS-CoV感染的研究一样。COVID-19患者的脂肪加速分解也被认为是一种可能的机制,但这需要进一步的研究。糖尿病和感染患者中非特定于COVID-19的因素包括免疫反应改变和反调节激素增加,这些激素促进肝脏葡萄糖生成,胰岛素分泌减少,生酮作用和胰岛素抵抗。COVID-19的关键肺外表现还可以与糖尿病并发症相关,从肾功能下降到血栓形成和凝血障碍状态,再到心功能不全和肝细胞损伤。
肥胖是COVID-19更严重疾病的另一个危险因素。这可能与其对肺功能的影响有关,例如肺容量减少和顺应性降低,气道阻力增加以及与糖尿病的关系。此外,肥胖的增加与多种细胞因子、趋化因子和脂肪因子的改变有关,包括促炎性细胞因子,如TNFα,IL-6,IL-8,瘦素和脂联素的增加,这些都有可能加剧本病患者的炎症反应。
除了威胁生命的SARS-CoV-2肺部并发症外,COVID-19广泛的器官特异性表现也越来越受到重视。随着世界各地的临床医生准备在可预见的将来护理COVID-19患者,必须全面了解这种多系统疾病的共同和特定器官的病理生理学和临床表现。科学家确定并追求明确的研究重点也很重要,这将有助于阐明尚不清楚的疾病的几个方面。一些需要进一步关注的领域包括阐明SARS-CoV-2传播到肺外组织的机制,了解可能增强肺外传播的病毒特性,免疫病理学的作用以及抗炎治疗的效果,对多器官损伤的长期影响的预期,确定导致疾病表现和严重程度差异的因素以及导致结果差异的生物学和社会机制。阅读原文